
【题目】Ⅰ.碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式: _________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是______________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为2Cu2I2+Hg===Cu2HgI4(玫瑰红)+ 2Cu,产物Cu2HgI4中Cu元素显_______价,当有1 mol Cu2I2参与反应时,转移电子数目______。
Ⅱ、过氧化钙可以用于改善地表水质,为测定过氧化钙产品中CaO2的含量,进行如下的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
(4)第一步发生反应的化学方程式为______________________________;
(5)样品中CaO2的质量分数为____________(用字母表示)。
【答案】 4KI+2CuSO4===I2+Cu2I2↓+2K2SO4 H2SO3>KI>Cu2I2 +1 NA CaO2+2KI+2H2SO4===I2+CaSO4+K2SO4+2H2O ![]() %
%
【解析】(1)反应中KI中I元素的化合价由-1价升高0生成单质碘I2,失去2e-,CuSO4中Cu元素的化合价由+2价降低为+1价,得到e-,根据得失电子数目相等可知二者最小公倍数为2,则硫酸铜前的系数为2,碘化亚铜前的系数为1,则结合质量守恒定律可知平衡后的化学方程式为:4KI+2CuSO4=I2+Cu2I2↓+2K2SO4,故答案为:4KI+2CuSO4=I2+Cu2I2↓+2K2SO4;
(2)由(1)解答可知,KI为还原剂,Cu2I2为还原产物,所以还原性KI>Cu2I2,往上述反应后溶液中加入淀粉,溶液变蓝,是因为碘单质和淀粉显示蓝色,再滴加亚硫酸溶液,蓝色又褪去是因为发生H2SO3+I2+H2O=H2SO4+HI,该反应中H2SO3是还原剂,I-是还原产物,还原性H2SO3>I-;故还原性由强到弱的顺序是H2SO3>KI>Cu2I2,故答案为:H2SO3>KI>Cu2I2;
(3)根据在化合物中正负化合价代数和为零可知:在Cu2HgI4中,设铜元素的化合价为x,则x×2+(+2)+(-1)×4=0,则x=+1;反应2Cu2I2+Hg=Cu2HgI4(玫瑰红)+2Cu中,Cu元素化合价部分由+1价降低到0价,被还原,Cu2I2为氧化剂,Hg元素化合价由0价升高到+2价,Hg为还原剂,当有1molCu2I2参与反应时,只有1molCu元素的化合价发生变化,转移1mol电子,数目为NA,故答案为:+1;NA;
(4)在酸性条件下,CaO2能将碘离子氧化成碘单质,反应的化学方程式为CaO2+2KI+2H2SO4===I2+CaSO4+K2SO4+2H2O,故答案为:CaO2+2KI+2H2SO4===I2+CaSO4+K2SO4+2H2O;
(5)过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmolL-1×V×10-3L=cV×10-3mol,根据反应的方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)= ![]() n(S2O32-)=
n(S2O32-)=![]() ×cV×10-3mol,样品中CaO2的质量分数为:
×cV×10-3mol,样品中CaO2的质量分数为:  ×100%=
×100%=![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为: ![]() %。
%。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列现象可以判断某一元酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以与石灰石反应放出CO2
C.该酸可以把Al(OH)3沉淀溶解
D.该酸浓度为0.1 mol·L-1时的pH为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钴酞菁”分子(直径约为1.34x10-9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 在分散系中,“钴酞菁”分子直径比Na+的直径小
D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离方法错误的是
A. 用过滤的方法除去食盐水中的泥沙
B. 用酒精萃取碘水中的碘
C. 用蒸馏的方法将自来水制成蒸馏水
D. 用分液的方法分离汽油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴,主要反应为:2Br-+Cl2=Br2+2Cl-,下列说法正确的是
A.溴离子具有氧化性B.氯气是还原剂
C.该反应属于复分解反应D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98﹪浓硫酸配制200 mL 0. 5mol.L-1的硫酸溶液,一定需要使用的玻璃仪器是
①玻璃棒 ②烧杯 ③烧瓶 ④量筒 ⑤容量瓶
A·①②③ B.①②④⑤ C·②③⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 . (填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2 . 该电池负极的电极反应式为 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJmol﹣1、283.0kJmol﹣1和890,0kJmol﹣1 .
写出CO与H2反应生成CH4和CO2的热化学方程式:
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示:
HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示: 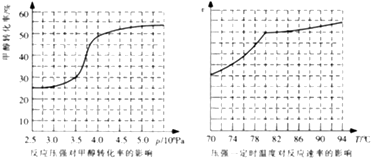
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 .
②实际工业生产中采用的温度是80℃,其理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的离子组是
A. NH4+、Mg2+、SO42-、NO3- B. Ba2+、Na+、OH-、Cl-
C. K+、NH4+、MnO4-、SO42- D. K +、Na+、NO3-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com