
| A. | 5s | B. | 大于5s | C. | 小于5s | D. | 无法判断 |
分析 先根据v=$\frac{△c}{△t}$=计算反应物的浓度由1mol/L降到0.4mol/L时的平均反应速率,再假设以相同的反应速率根据t=$\frac{△c}{v}$计算反应物的浓度由0.4mol/L降到0.1mol/L所需反应时间,实际上化学反应进行过程中,反应物不断被消耗,浓度逐渐降低,反应速率逐渐变慢,据此分析解答.
解答 解:反应物的浓度由1mol/L降到0.4mol/L时的平均反应速率v=$\frac{△c}{△t}$=$\frac{1mol/L-0.4mol/L}{10s}$=0.0.06mol/(L•s),假设以0.06mol/(L.s)的反应速率计算反应物X的浓度由0.4mol/L降到0.1mol/L所需反应时间t=$\frac{△c}{v}$=$\frac{0.4mol/L-0.1mol/L}{0.06mol/(L•s)}$=5s,实际上X物质的化学反应速率是随着物质浓度的减小而减小,所以反应物的浓度由0.4mol/L降到0.1mol/L时的平均反应速率小于0.06mol/(L.s),所以所用时间应大于5s,
故选B.
点评 本题考查了化学反应速率的有关计算,难度中等,明确化学反应速率是平均值不是瞬时值,化学反应速率随浓度的变化而变化.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| B. | 除去溴苯中的溴,可用NaOH溶液洗涤,再分液 | |
| C. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 | |
| D. | 寻找合适催化剂提高合成氨工业中原料的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 1 | 浓硫酸 | 稀硫酸 | |
| 物理性质 | 加水 | 放出大量的热 | 现象不明显 |
| 观察态 | 无色粘稠状液体 | 无色液体 | |
| 密度 | 浓硫酸的密度大于稀硫酸 | ||
| 化学性质 | 铁片 | 发生钝化 | 铁片逐渐溶解,并产生无色气体 |
| 铜片(加热) | 刺激性气体 | 无现象 | |
| 白纸 | 变黑 | 无现象 | |
| 胆矾 | 变成白色 | 无现象 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用铁槽车装运冷浓硝酸是因为铁与冷的浓硝酸不反应 | |
| B. | 在人体的血红蛋白中含有铁元素 | |
| C. | 铁在潮湿的空气中会生锈 | |
| D. | 铁能在氧气中剧烈燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:2 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>B>A | |
| B. | A与其它3种元素均能形成共价化合物 | |
| C. | 室温下,A、C、D的最简单氢化物溶于水形成的水溶液pH都小于7 | |
| D. | 元素B、C、D各自最高和最低化合价的代数和分别为2、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
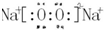 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与NaOH溶液反应 | B. | NaHCO3溶液与澄清石灰水反应 | ||
| C. | KHCO3溶液与澄清石灰水反应 | D. | Ca(HCO3)2溶液与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com