
分析 (1)根据c(酸)=$\frac{c(标准)×V(标准)}{c(待测)}$判断不当操作对测定结果的影响;
(2)直接装入标准溶液,标准液的浓度偏低;
(3)若溶液颜色变化且半分钟内不变色,可说明达到滴定终点.
解答 解:(1)①锥形瓶不能润洗,若锥形瓶用待测液润洗2~3次,导致待测液中溶质的物质的量偏大,测定结果偏高,
故答案为:A;
②滴定前滴定管尖嘴有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,
故答案为:A;
③滴定前仰视读数,滴定后平视读数,导致最终读数偏小,测定结果偏低,
故答案为:B;
④摇动锥形瓶时,有少量液体溅出,导致标准液中溶质的物质的量偏小,测定结果偏低,
故答案为:B;
⑤滴定时,锥形瓶里加入少量蒸馏水,对待测液中溶质的物质的量无影响,则不影响测定结果,
故答案为:C.
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,
故答案为:洗去滴定管内壁附着的水,防止将标准溶液稀释而带来误差;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
点评 本题考查中和滴定,题目难度中等,明确中和滴定原理及操作方法为解答关键,误差分析为难点、易错点,注意根据c(酸)=$\frac{c(标准)×V(标准)}{c(待测)}$判断不当操作产生误差,试题培养了学生的分析能力及化学实验能力.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 10mL18mol/L浓硫酸与足量铜加热充分反应,转移电子数为0.18NA | |
| B. | 11gT2O超重水中含有的中子数为5NA | |
| C. | 标准状况下,22.4LCO2中含有的共用电子对数为2NA | |
| D. | 7.8 gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常 简写为BnCl,
简写为BnCl, 简写为CbzCl ):
简写为CbzCl ):
 显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
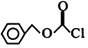 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为 (任写一种).
(任写一种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、D两种元素形成的化合物中只含有极性键 | |
| B. | A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 | |
| C. | 六种元素中,最高价氧化物对应水化物酸性最强的元素是C | |
| D. | 原子半径由大到小的顺序是F>E>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 两个容积均为2L 的密闭容器I和Ⅱ中发生反应2NO(g)+2CO(g)?N2(g)+2CO(g),起始物质的量见表.
两个容积均为2L 的密闭容器I和Ⅱ中发生反应2NO(g)+2CO(g)?N2(g)+2CO(g),起始物质的量见表.| 容器 | 起始物质的量 | |
| NO | CO | |
| Ⅰ | 1mol | 3mol |
| Ⅱ | 6mol | 2mol |
| A. | N点的平衡常数为0.04L/mol | |
| B. | M、N两点容器内的压强:P(M)>2P(N) | |
| C. | 若将容器I的容积改为1L,T1温度下达到平衡时c(CO2)=0.25mol/L | |
| D. | 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率大于16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(B)=0.015mol/(L•s) | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20molA、0.20molB和1.0molC,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ③白磷 ④18O ⑤
③白磷 ④18O ⑤ ⑥红磷 ⑦16O ⑧氯气 ⑨H2O ⑩D2O
⑥红磷 ⑦16O ⑧氯气 ⑨H2O ⑩D2O ,写出酒精的同分异构体二甲醚的结构式
,写出酒精的同分异构体二甲醚的结构式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com