
根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g)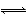 2HI(g) ΔH=-9.48 kJ
2HI(g) ΔH=-9.48 kJ
(2)I2(s)+H2(g)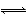 2HI(g) ΔH=26.48 kJ
2HI(g) ΔH=26.48 kJ
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(1)的产物比反应(2)的产物稳定
D.反应(2)的反应物总能量比反应(1)的反应物总能量低
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:填空题
已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g) ΔH=+177.7 kJ
CaO(s)+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
③HCl(l)+NaOH(l) NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+O2(g) CO2(g) ΔH=-283 kJ·mol-1
CO2(g) ΔH=-283 kJ·mol-1
⑥2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 。
(2)上述反应中,表示燃烧热的热化学方程式有 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)4.1原电池试卷(解析版) 题型:选择题
下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:

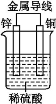
卡片上的描述合理的是( )
A.①②③ B.③④⑤ C.①⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.1 化学反应速率试卷(解析版) 题型:选择题
在可逆反应2A(g)+3B(g)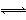 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A 为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A 为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(解析版) 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l) H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼和二氧化氮反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:填空题
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
A.容器中的压强不变
B.1 mol H—H键断裂的同时断裂2 mol H—O键
C.v正(CO)=v逆(H2O)
D.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为 (填“吸”或“放”)热反应。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
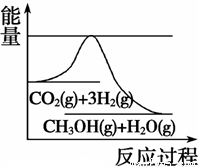
A.升高温度
B.充入N2(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入0.5 mol CO2和1.5 mol H2
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
A.反应速率:乙>甲 B.平衡混合物中SO2的体积分数:乙>甲
C.SO2的转化率:乙>甲 D.平衡时O2的浓度:乙>甲
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期第一次月考理综试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用。利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:

1—浸泡罐;2、3—反应罐;4—板式过滤机;5、10—浓缩罐;
6—脱色柱;12—离心机(固液分离装置)
已知:木糖与木糖醇的转化关系如图:
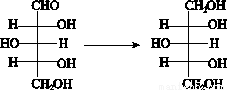
请回答下列问题:
(1)装置2中硫酸的主要作用是________。
(2)装置3中加入碳酸钙的目的是_____________________________________。
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是_____________________。
(4)装置9的作用是________。
A.冷却木糖浆 B.水解木糖 C.氧化木糖 D.还原木糖
(5)装置11的作用是________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应
Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com