
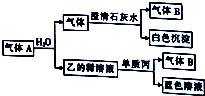
 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:分析 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,气体A与水反应又得到乙溶液,而乙的稀溶液与丙反应得到蓝色反应,则丙为Cu、乙为HNO3,气体B是NO,故A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,则A中含有CO2、NO2,可知甲是C,据此解答.
解答 解:将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,气体A与水反应又得到乙溶液,而乙的稀溶液与丙反应得到蓝色反应,则丙为Cu、乙为HNO3,气体B是NO,故A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,则A中含有CO2、NO2,可知甲是C.
(1)甲是C,B是NO,故答案为:C;NO;
(2)乙的溶液通常呈黄色,是因为溶解二氧化氮,消除黄色且不降低乙溶液的浓度的方法:向硝酸的浓溶液中缓慢通入氧气至溶液呈无色,
故答案为:向硝酸的浓溶液中缓慢通入氧气至溶液呈无色;
(3)生成混合气体A的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)硝酸稀溶液与Cu反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,涉及碳、氮元素单质及化合物的性质,E溶液为蓝色是推断的突破口,据此可以推断丙,再结合转化关系确定乙为硝酸,熟练掌握元素化合物的性质是关键.


科目:高中化学 来源: 题型:选择题

| A. | 是a mL | B. | 是(50-a)mL | C. | 一定大于a mL | D. | 一定大于(50-a)mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )| A. | ②③⑤ | B. | ①④⑤ | C. | ①②③ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取6.8mL稀H2SO4 | |
| B. | 用碱式滴定管量取15.80mLKMnO4溶液 | |
| C. | 酸碱中和滴定时,滴定管需用标准液或待测液润洗 | |
| D. | 中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醇被氧化转移6mol电子 | |
| B. | C2H5OH在电池的负极上参加反应 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极的电极反应式为4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、④-
、④- 、⑨-
、⑨- ),则该化合物的化学式为:MgCNi3(用元素符号表示).
),则该化合物的化学式为:MgCNi3(用元素符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2Fe3+═Cu2++2Fe2+ | |
| C. | 铜片和氯化铁溶液反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com