
| A. | CO是酸性氧化物 | B. | BaSO4 是强电解质 | ||
| C. | 氢氧化铁胶体属于纯净物 | D. | 纯碱属于碱类物质 |
分析 A.酸性氧化物是和碱溶液反应生成盐和水的氧化物,发生的是复分解反应;
B.水溶液中或熔融状态下导电的化合物为电解质;
C.同种物质组成的为纯净物,胶体是分散质和分散剂组成的分散系;
D.纯碱是碳酸钠属于盐.
解答 解:A.酸性氧化物是和碱溶液反应生成盐和水的氧化物,发生的是复分解反应,CO和碱不反应属于不成盐氧化物,不是酸性氧化物,故A错误;
B.水溶液中或熔融状态下导电的化合物为电解质,BaSO4 熔融状态能导电是强电解质,故B正确;
C.同种物质组成的为纯净物,胶体是分散质和分散剂组成的分散系,氢氧化铁胶体属于混合物,故C错误;
D.纯碱是钠离子和碳酸根离子构成,碳酸钠属于盐,故D错误;
故选B.
点评 本题考查了物质分类、物质组成,主要是氧化物分类、电解质判断等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用甲醛溶液浸泡海产品保鲜 | |
| B. | 无水乙醇常用作医用消毒剂 | |
| C. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| D. | 做衣服的棉和麻均与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、HCl、H2O、NaOH | B. | Cl2、Na2S、HCl、CO2 | ||
| C. | HBr、CCl4、H2O、CO2 | D. | Na2O2、H2O2、H2O、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H20中含有的分子数为NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05NA | |
| C. | 7.lgCl2 与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA | |
| D. | 1L lmol/L CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
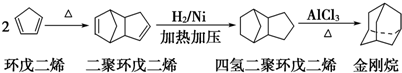
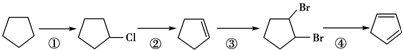
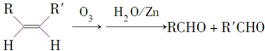 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: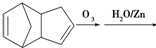
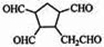 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应BrCl+H2O═HCl+HBrO中,BrCl既是氧化剂又是还原剂 | |
| B. | 双氧水与高锰酸钾酸性溶液反应:2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | K37ClO3与H35Cl反应的化学方程式为K37ClO3+6H35Cl═K37Cl+335Cl2↑+3H2O | |
| D. | 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移4NA个电子(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
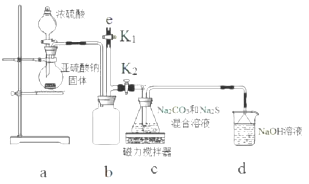
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1mol氢气与1mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 在相同条件下,1mol氢气与1 mol氟气的总能量大于2mol氟化氢气体的能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com