
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐增大
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
科目:高中化学 来源: 题型:
【题目】我国对二氧化硫一空气质子交换膜燃料电池的研究处于世界前沿水平,该电池可实现硫酸生产、发电和环境保护三位一体的结合。其原理如图所示。下列说法不正确的( )
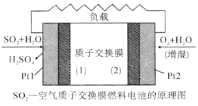
A.Pt1电极附近发生的反应为:SO2 + 2H2O-2e- = SO42-+4H+
B.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
C.该电池工作时质子从Pt2电极经过内电路流到Pt1电极
D.该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究肉桂酸的制取:
I:主要试剂及物理性质

注意:乙酸酐溶于水发生水解反应
II :反应过程.
实验室制备肉桂酸的化学方程式为: 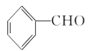 +(CH3CO2)O
+(CH3CO2)O![]()
![]() +CH3COOH
+CH3COOH
III::实验步骤及流程
①在250 mL三口烧瓶中(如图甲)放入3 ml(3. 15 g,0. 03 mol)新蒸馏过的苯甲醛、8 ml(8. 64g,0. 084 mol)新蒸馏过的乙酸酐,以及研细的4.2 g无水碳酸钾。采用空气冷凝管缓缓回流加热45min。由于反应中二氧化碳逸出,可观察到反应初期有大量泡沫出现。
②反应完毕,在搅拌下向反应液中分批加入20 mL水,再慢慢加入碳酸钠中和反应液至pH等于8。然后进行水蒸气蒸馏(如图乙),待三口烧瓶中的剩余液体冷却后,加入活性炭煮沸10-15 min,进行趁热过滤。在搅拌下,将HCl加入到滤液中,当固体不在增加时,过滤,得到产品,干燥,称量得固体3.0 g。
IV:如图所示装置:

回答下列问题:
(1)合成时装置必须是干燥的,理由是___________。反应完成后分批加人20mL水,目的是________。
(2)反应完成后慢慢加入碳酸钠中和,目的是_____。
(3)步骤②进行水蒸气蒸馏,除去的杂质是______,如何判断达到蒸馏终点__________。
(4)加入活性炭煮沸10- 15 min,进行趁热过滤,将滤液冷却至室温,趁热过滤的目的是_______。
(5)若进一步提纯粗产品,应用的操作名称是______,该实验产品的产率约是_______。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。

已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。

(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:

该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察:
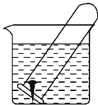
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于_____腐蚀。
(2)若试管内液面上升,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:________。
(3)若试管内液面下降,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:______________。
(4)若溶液甲为水,溶液乙为海水,则铁钉在____(填“甲”或“乙”)溶液中腐蚀的速度快。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
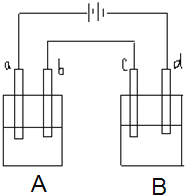
(1)写出A、B两池中阳极电极反应式________。
(2)计算标准状况下气体各为多少升?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
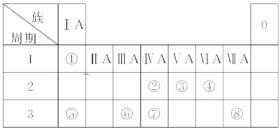
(1)上述八种元素中,最高价氧化物的水化物酸性最强的化合物的化学式是________(填化学符号,下同),最高价氧化物的水化物碱性最强的化合物的化学式是________,最高价氧化物的水化物显两性的氢氧化物的化学式是________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是___________________。
(3)④、⑤、⑥的简单离子半径由大到小的顺序是 ___________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,用电石(主要成分为CaC2,含少量CaS)制取乙炔。
(1)实验室制取乙烯的化学方程式为_____________________________,可用于制取乙烯的发生装置是_______。(选填编号)
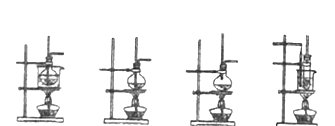
a b c d
(2)制备乙烯气体时,常因温度过高而观察到溶液变黑,同时能闻到有刺激性气味的气体生成。在乙烯气体的制备过程中,浓硫酸没有体现的性质是________。
a 吸水性 b 脱水性 c 强氧化性 d 酸性
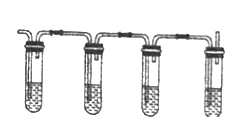
① ② ③ ④
有同学设计下列实验确认上述混合气体中有乙烯和二氧化硫。
上图中①、②、③、④装置盛放的试剂分别是(根据需要进行选择,填标号):
①_______________,②_______________,③_______________,④______________。
A 品红溶液 B NaOH溶液 C 浓硫酸 D 酸性高锰酸钾溶液
(3)实验室制备乙炔的化学反应方程式为_________________________________。实验室制乙炔时为避免电石和水反应过于激烈,除用分液漏斗控制滴速外,通常还可用_________代替水。为除去乙炔中混有的少量硫化氢杂质,可将气体通过___________(选填编号)。
a酸性KMnO4溶液 b CCl4 c NaOH溶液 d CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示装置时行实验:
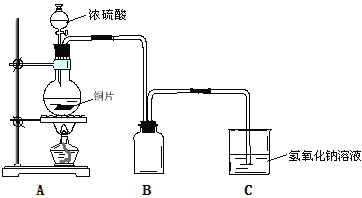

(1)B是用来收集实验中产生的气体的装置,装置图补充完整后正确的是__________;

(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___________(填写字母编号)。
A.硫酸钠溶液 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是__________________________。
(3)为了确定反应生成的主要气体成分,还可以在实验装置A和B之间补充以上右图D装置,其中洗气瓶中可以盛有__________(试剂)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com