



 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、SO42- |
| C、室温下,pH=12的溶液:K+、Ba2+、Cl-、Br- |
| D、碳酸氢钠溶液:K+、SO42-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B、用石膏点豆腐 |
| C、不良商贩用硫黄熏蒸银耳制作“雪耳” |
| D、自来水厂用二氧化氯对水进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氧化铜与稀硫酸反应:CuO+2H+=Cu2++H2O |
| C、氢氧化钡和硫酸溶液反应:OH-+H+=H2O |
| D、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
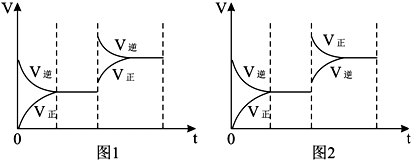
| A、开始时充入X和Y a+b>c+d Q<0 |
| B、开始时充入X和Y a+b>c+d Q>0 |
| C、开始时充入Z和R a+b>c+d Q<0 |
| D、开始时充入Z和R a+b<c+d Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | MgCl2溶液 | 酚酞溶液 | NaCl溶液 |
| ③ | Na2O | Na2CO3 | NaHCO3 |
| ④ | KOH溶液 | Al | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、四氧化三铁溶于稀硝酸:Fe3O4+8H+=4H2O+Fe2++2Fe3+ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com