
【题目】实验室用如图装置制取少量溴苯,试填写下列空白。

(1)在烧瓶a中装的试剂是铁粉、______和_____。
(2)请你推测长直导管b的作用:__。
(3)请你分析导管c的下口可否浸没于液面中_____?为什么?_____。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有_____生成,此现象说明这种获得溴苯的反应属于_____。(填有机反应类型)
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】若将 SO2 通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平): SO2+ Ba(NO3)2+ H2O —— BaSO4↓+ HNO3+ NO↑
(1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目________。
(2)该反应中,_______发生氧化反应,氧化剂是_______。氧化产物与还原产物的物质的量之比为 _______。
(3)当反应消耗二氧化硫 19.2 g 时,反应中转移电子数目为_______ ,生成 NO 的体积为 _______(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
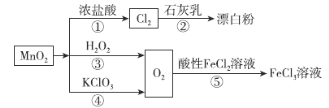
A.反应①中氧化剂与还原剂的物质的量之比为1:4
B.反应①②③④⑤均属于氧化还原反应
C.生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应⑤的离子反应方程式为2Fe2++O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
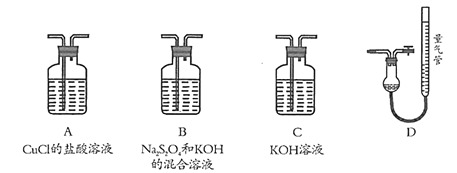
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
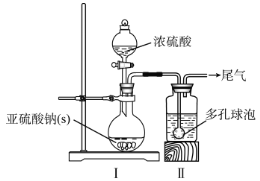
(1)装置Ⅰ中产生气体的化学反应方程式为__;Ⅱ中多孔球泡的作用是__。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为___;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__;吊白块样品的纯度为__%(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在日常生活中有广泛应用。漂白液通常用于家庭和公共场所的消毒,某品牌漂白液的包装说明如下:

(1)该漂白液中,NaClO的物质的量浓度约为___ mol·L-1。
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式___,制取500mL此漂白液,需要5.0mol·L-1的NaOH溶液___mL。
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下有机物:
①![]() ②
②![]() ③
③![]()
④CH3CH=CHCH3⑤![]() ⑥
⑥![]() ⑦
⑦![]()
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;
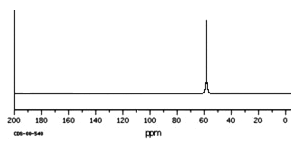
(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:____________________;
(4)有机物④的系统命名法名称是_____________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com