
【题目】有4瓶常用溶液:①BaCl2溶液,②NaCl溶液,③Na2SO4溶液,④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序是( )
A. ④③①② B. ①③④② C. ④①③② D. ①④②③
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
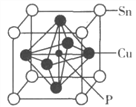
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溴单质的沸点为 59 ℃,微溶于水,有毒性和强腐蚀性。某学习小组在探究从工业溴中提溴单质的实验中使用如下装置:

(1)①实验室保存液溴的方法是:_____,图中仪器 B 的名称是:_____。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_____。
④C 中液体产物的颜色为_______,为除去该产物中仍残留的少量 Cl2,可向其中加入 NaBr 溶液,充 分反应后,再进行的分离操作是_______(填操作名称)。
⑤工业上常用 SO2 水溶液吸收 Br2,有关反应的离子方程式为__________。
(2)Br2 和 FeCl3 的稀溶液均呈黄色。将少量稀溴水滴入稀 FeCl2 溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,他认为二者未发生化学反应,该实验设计不正确,错误在于____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体
B. C6Hn分子中的六个碳原子在同一直线上,则n可能等于2
C. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同
D.  与
与 都是酚且互为同系物
都是酚且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物(即由两种元素组成的化合物),n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
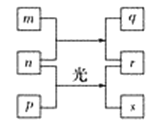
A. n+p→r+s属于置换反应
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中导电性最强的是
A. 1L0.1mol/L醋酸B. 0.1L 0.1mol/L H2SO4溶液
C. 0.5L 0.1mol/L盐酸D. 2L 0.1mol/L H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:

实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气.
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热D并关闭旋塞.
③向装置A中b容器内充入加热介质并加热到210一220℃,然后通入N2O.
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶.
⑤过滤,用乙醚洗涤,晾干.
已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解.
回答下列问题:
(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是___.
(2)装置B中盛放的药品为___;装置C的主要作用是___.
(3)步骤①先加热通氨气的目的是___;步骤②氨气与熔化的钠反应的方程式为___.
(4)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是___.
(5)生成NaN3的化学方程式为___.
(6)步骤⑤用乙醚洗涤的主要目的是___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com