
| A.全部由非金属元素组成的化合物可能是离子化合物 |
| B.金属原子与非金属原子之间的化学键可能是离子键,也可能是共价键 |
| C.晶体中有阳离子,则必定有阴离子 |
| D.晶体中有阴离子,则必定有阳离子 |
科目:高中化学 来源:不详 题型:填空题
 。
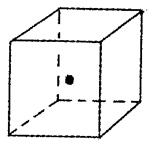
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 有A、C两元素的微粒是 。(写化学式)
有A、C两元素的微粒是 。(写化学式)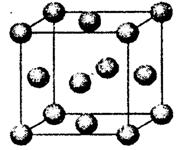
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
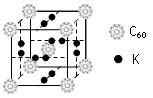
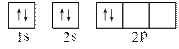

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体中只存在离子键 |
| B.原子晶体中只存在非极性共价键 |
| C.冰是水分子间主要通过氢键作用有规则排列成的分子晶体 |
| D.液态氯化钠和铜导线的导电原理是相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子晶体中可能存在极性共价键 | B.干冰升华时分子内共价键发生断裂 |
| C.原子晶体的熔点比分子晶体的熔点高 | D.离子晶体中只含离子键,不含共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.干冰 | B.晶体硅 | C.氩 | D.二氧化硅 E.氯化铵 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com