
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
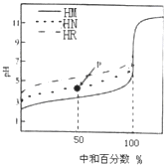
A. 三种酸的电离常数关系: KHR>KHN>KHM
B. pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C. 滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+)
【答案】AC
【解析】A项,三种酸(HM、HN和HR)溶液浓度均为0.1mol·L-1,酸的pH越大说明该酸的电离程度越小,则该酸的电离常数越小,由图可得,未加NaOH溶液时三种酸的pH大小顺序是HR>HN>HM,则三种酸的电离程度HR<HN<HM,所以三种酸的电离常数KHM>KHN>KHR,故A错误;B项,pH=7时,溶液呈中性,c(OH-)=c(H+),根据电荷守恒,三种酸溶液中分别存在c(M-)=c(Na+)、c(N-)=c(Na+)、c(R-)=c(Na+),相同浓度、相同体积的三种酸溶液与NaOH中和至中性时,酸的电离程度越大消耗NaOH的体积越大,则混合溶液中钠离子浓度越大,因为三种酸的电离常数KHM>KHN>KHR,则三种酸消耗NaOH的体积:HM>HN>HR,所以三种溶液中c(M-)>c(N-)>c(R-),故B正确;C项,由图可知,P点溶液呈酸性,c(H+)>c(OH-),溶液为等物质的量浓度的NaN和HN的混合溶液,因为溶液呈酸性,说明HN的电离程度大于N-水解程度,结合物料守恒可知,溶液中:c(N-)>c(Na+)>c(HN)>c(H+)>c(OH-),故C错误;D项,因为三种酸的初始浓度和体积均相同,所以当中和百分数达100%时,将三种溶液混合后,根据质子守恒得:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+),故D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜、碱式氯化铜都是重要的无机杀菌剂及饲料中铜的添加剂。
I、碱式碳酸铜的制取:将小苏打配成溶液,先加入反应器中,于50℃时,在搅拌下加入精制的硫酸铜溶液,控制反应温度在70℃~80℃,反应以沉淀变为蓝绿色悬浊液为度,pH值保持在5左右,反应后经静置,沉降,用70℃~80℃蒸馏水洗涤,再用无水乙醇洗涤,再经离心分离、干燥,制得碱式碳酸铜成品。
(1)控制反应温度在70℃~80℃的方法是________________。
(2)控制pH在5左右的原因是______________。
(3)CuSO4溶液与NaHCO3溶液反应制取碱式碳酸铜的化学方程式为________________。
II.碱式氯化铜的制备有多种方法。
(4)如在45℃~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为__________________。
也可采用CuCl2与石灰乳反应生成城式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反成有催化作用,其催化原理如图所示。M的化学式为_______________。

Ⅲ.如图探究实验I所制得的蓝绿色固体。

(5)B 装置的作用是________。C 中盛装的试剂应是_______。D装置加热前,需要如何操作?__________。
(6)若蓝绿色固体的组成xCuCO3·yCu(OH)2,实验能现察到的现象是__________。
(7)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各微粒:①NH4+、Na+;②OH-、F-;③Na+、Mg2+;④CH4、H2O。其中具有相同质子数和电子数的一组是( )
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。

(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯、玻璃棒外有________。
(2)步骤2中发生反应的化学方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中的离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl﹣、OH﹣
B.H+、Ca2+、CO32﹣、NO3﹣
C.Cu2+、K+、SO42﹣、NO3﹣
D.Na+、H+、OH﹣、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应式书写正确的是( )
A. 制取氢氧化铁胶体的化学方程式为FeCl3+3H2O![]() Fe(OH)↓+3HCl
Fe(OH)↓+3HCl
B. 亚硫酸在溶液中的电离方程式为H2SO3![]() 2H++SO32-
2H++SO32-
C. NaHCO3水解的离子方程式为HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. 泡沫灭火器工作原理离子方程式为Al3++3HCO3-=3CO2↑+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中不能大量共存的是( )
A.Na+、CO32-、Ba2+、OH-B.Cu2+、Na+、NO3-、SO42-
C.Na+、K+、Cl-、HCO3-D.K+、Na+、NO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com