
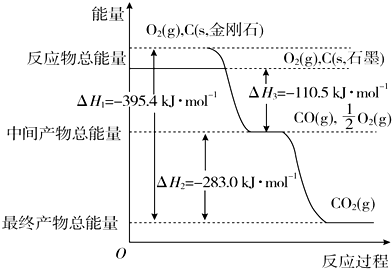
���� ��1�����ٻ�ʯ��Դ��ʹ�ã���������Դ�������ڡ���Դ��������
��2����ͼ��֪����������ͬ����Ӧ���н��ʯ����������ʯī��������1mol��������ȫȼ�շų�������Ϊȼ���ȡ����ʵ��������������ȣ�
��3���ʱ���ڶϼ����յ�������ȥ�ɼ��ͷŵ�������
��4����Ϣ�C��ʯī��s��+O2��g���TCO2��g����H=-393.5 kJ•mol-1 ��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1����N2��g��+O2��g���T2NO��g����H=+180.0kJ•mol-1����˹���ɿ�֪���١�2-�ڡ�2-�۵� 2NO��g��+2CO��g���TN2��g��+2CO2��g����
��� �⣺��1��A��������չũ���������������Ľո�ת��Ϊ����Ч����Դ���ɼ��ٻ�ʯ��Դʹ�ã���ѡ��
B����������ú��ʯ�ͺ���Ȼ��������������������������Դ�����ܼ��ٻ�ʯȼ�ϵ����ã��ʲ�ѡ��
C������̫���ܡ�ˮ�ܡ����ܡ������ܵ�����Դ������ʹ��ú��ʯ�͵Ȼ�ʯȼ�ϣ����ϡ���Դ����������ѡ��
D��������Դ���ģ�ע����Դ���ظ�ʹ�á���Դ��ѭ���������ܼ��ٻ�ʯȼ�ϵ���Դʹ�ã���ѡ��
�ʴ�Ϊ��ACD��
��2������ͼ��֪�����ʯ��������ʯī������Խ��Խ�ȶ�������˵��ʯī�ȶ���ͼ��1molʯī��ȫȼ������1mol������̼�ų�������Ϊ393.5kJ����ʯī��ȼ����Ϊ��H=-393.5kJ?mol-1��
�ʴ�Ϊ��ʯī����H=-393.5kJ?mol-1��
��12gʯī���ʵ���Ϊ1mol����һ����������ȼ�գ�����Ԫ���غ㣬�����ɶ�����̼����Ϊ44g��������һ����̼����Ϊ28g����������36g��28g��36g��44g���ж����ɵ�����Ϊһ����̼�Ͷ�����̼���壬��һ����̼���ʵ���Ϊx��������̼���ʵ���Ϊ��1-x��mol��28x+44��1-x��=36g��x=0.5mol��������̼���ʵ���Ϊ0.5mol�����ͼ���֪C��ʯī��s��+O2��g���TCO2��g����H=-393.5 kJ•mol-1 ��C��ʯī��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5 kJ•mol-1
���ɶ�����̼��һ����̼�������ų�����=393.5 kJ•mol-1 ��0.5mol+110.5 kJ•mol-1 ��0.5mol=252KJ��12gʯī��һ����������ȼ�գ���������36g���ù��̷ų�������Ϊ252.0kJ��
�ʴ�Ϊ��252.0 kJ��
��3������N2��O2�����л�ѧ���ļ��ֱܷ���946kJ•mol-1��497kJ•mol-1�Լ���ӦN2��g��+O2��g��=2NO��g����H=+180kJ•mol-1����NO�����л�ѧ���ļ���ΪX�����У�946kJ•mol-1+497kJ•mol-1-2X=180kJ•mol-1 �ã�X=631.5kJ•mol-1��
�ʴ�Ϊ��631.5��
��4����C��ʯī��s��+O2��g���TCO2��g����H=-393.5 kJ•mol-1
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1
��N2��g��+O2��g���T2NO��g����H=+180.0kJ•mol-1��
�ɸ�˹���ɿ�֪�١�2-�ڡ�2-�۵� 2NO��g��+2CO��g���TN2��g��+2CO2��g����H=-746.0kJ?mol-1��
�ʴ�Ϊ��2NO��g��+2CO��g���TN2��g��+2CO2��g����H=-746.0kJ?mol-1��
���� ���⿼�鷴Ӧ�����ʱ䣬Ϊ��Ƶ���㣬���շ�Ӧ�������仯�����ʵ����������Ĺ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���H�ļ��㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������£�HD�ܻ�ԭ����ͭ | |
| B�� | HD����������ȼ������HCl��DCl���� | |
| C�� | ��һ�ַǽ������� | |
| D�� | ��һ�ֻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
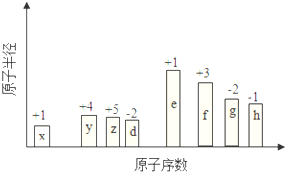 ��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��
��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��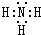 ��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3��
��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ԫ��Q��R��T��W��Ԫ�����ڱ���λ����ͼ��ʾ������T��������������������������ȣ�
������Ԫ��Q��R��T��W��Ԫ�����ڱ���λ����ͼ��ʾ������T��������������������������ȣ� ��R������⻯��ĵ���ʽΪ
��R������⻯��ĵ���ʽΪ ��Q��1��1���⻯������Է���������С�ķ�����ֱ���ͷ��ӣ����幹�ͣ���
��Q��1��1���⻯������Է���������С�ķ�����ֱ���ͷ��ӣ����幹�ͣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��s��+$\frac{1}{2}$O2��g��=CO��g������H1 C��s��+O2��g��=CO2��g������H2 | |
| B�� | $\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g��=HCl��g������H1H2��g��+Cl2��g��=2HCl��g������H2 | |
| C�� | 2H2��g��+O2��g��=2H2O��g������H1 2H2��g��+O2��g��=2H2O��l������H2 | |
| D�� | S��g��+O2��g��=SO2��g������H1 S��s��+O2��g��=SO2��g������H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{a}{14}$ mol-1 | B�� | $\frac{a}{28}$ mol-1 | C�� | 14a mol-1 | D�� | 28a mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com