
分析 (1)已知:①2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2kJ•mol-1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1806.4kJ•mol-1
根据反应:2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)②-①得到,根据盖斯定律计算反应的焓变;
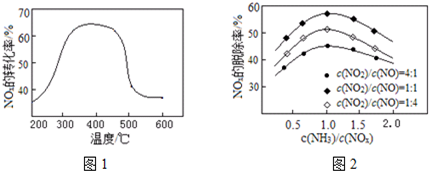
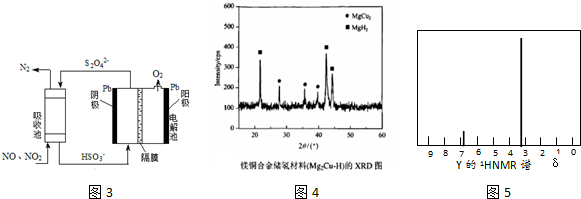
(2)NOx的转化率随温度升高而降低;催化剂可以加快反应速率;根据纵坐标判断,相同温度下,脱除率越高的效果越好,脱氮反应是氨气和二氧化氮、一氧化氮发生氧化还原反应生成氮气和水;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,根据电子守恒来计算;
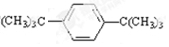
(4)镁铜合金(Mg2Cu)贮氢时在高温高压下与氢气反应后的产物的XRD谱如图4所示生成的是MgCu2和3MgH2,结合原子守恒配平书写化学方程式;
(5)铝碳酸镁[Al2Mg6(OH)16CO3•4H2O]是一种抗酸剂,和胃酸中的盐酸反应生成氯化铝、氯化镁、水、二氧化碳,结合原子守恒配平书写;
(6)有机镁化合物X(化学式为:C8H18MgO2)可发生如下反应:C8H18MgO2+2H2O→2Y+Mg(OH)2,Y的核磁共振氢谱如图5所示,则X的结构中含有一种氢原子,结合原子守恒和结构特征写出X的结构简式.
解答 解:(1)已知:①2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2kJ•mol-1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1806.4kJ•mol-1
根据反应:2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)②-①得到,根据盖斯定律计算反应的焓变=$\frac{1}{2}$(-1806.4kJ•mol-1+734.2kJ•mol-1)=-536.1kJ•mol-1,故答案为:-536.1;
(2)当反应在400~450℃,NOx的转化率随温度升高有所降低,其可能原因是反应放热,升高温度,平衡向逆方向进行,当体系温度升至500℃以上时,FeSO4受热分解,催化剂失效,NOx的转化率迅速下降,烟气中NH3、NO、NO2不同比例时氮氧化物脱除率,当c(NO):c(NO2)=1:1时氮氧化物脱除率最高,根据2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g),则c(NH3):c(NO):c(NO2)=2:1:1时,氮氧化物脱除效果最佳,
故答案为:反应放热,升高温度,平衡向逆方向进行;FeSO4受热分解,催化剂失效;2:1:1;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;隔膜可采用阳离子交换膜,吸收池中生成的N2的反应:2NO+2S2O42-+2H2O═N2+4HSO3-,阳极上产生氧气的反应为:4OH--4e-=O2↑+2H2O,若吸收池中生成的N2和电解池中生成的O2的体积比为3:4,根据电子守恒,则通入吸收池NO和NO2体积比为2:1,
故答案为:2HSO3-+2e-+2H+=S2O42-+2H2O;阳离子;2:1;
(4)镁铜合金(Mg2Cu)贮氢时在高温高压下与氢气反应后的产物的XRD谱如图4所示生成的是MgCu2和3MgH2,结合原子守恒配平书写化学方程式为:2Mg2Cu+3H2=MgCu2+3MgH2,
故答案为:2Mg2Cu+3H2=MgCu2+3MgH2;
(5)铝碳酸镁[Al2Mg6(OH)16CO3•4H2O]是一种抗酸剂,和胃酸中的盐酸反应生成氯化铝、氯化镁、水、二氧化碳,反应的化学方程式为:
Al2Mg6(OH)16CO3•4H2O+18HCl=2AlCl3+6MgCl2+CO2↑+21H2O,1mol铝碳酸镁与盐酸反应时,最多消耗盐酸的物质的量为18mol,
故答案为:18mol;
(6)有机镁化合物X(化学式为:C8H18MgO2)可发生如下反应:C8H18MgO2+2H2O→2Y+Mg(OH)2,Y中含4个碳,10个氢原子,1个氧原子,Y的分子的核磁共振氢谱如图5所示,Y 中含一种氢原子,结构简式为:(CH3)3COH,则X的结构简式为,[(CH3)3CO]2Mg,
故答案为:[(CH3)3CO]2Mg.
点评 本题考查较综合,涉及图象分析、电解池工作原理以及盖斯定律的应用等知识点,利用溶度积常数,注意图象分析中的曲线的变化趋势,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: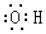 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| D. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素 | B. | 蔗糖和麦芽糖 | ||
| C. | 分子式为C4H6和C5H8的烃 | D. | 分子式为C4H10和C20H42的烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 检验氨气时,需用玻璃棒沾取湿润的红色石蕊试纸靠近导管口 | |
| C. | 用稀硝酸溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com