
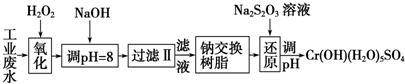
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
分析 I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,注意不能引入新的杂质;
(2)根据表中数据判断;通过钠离子交换树脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,结合得失电子守恒和原子守恒写出离子方程式;
II.(1)铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应;
(2)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4,
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
故答案为:AB;CD;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-+,则反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9 mol/L,
c(H+)═$\frac{10{\;}^{-14}}{10{\;}^{-9}}$=10-5mol/L,pH=5,
即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
点评 本题考查了物质分离提纯的操作及方法应用、电解原理、难溶物溶度积的计算等,题目难度较大,涉及的知识点较多,注意掌握电解原理、难溶物溶度积的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
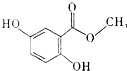
| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.68g | B. | 4.48g | C. | 5.60g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | Z | |
| X | Y |
| A. | 原子半径:Z<W<Y<X | |
| B. | Z的最高价氧化物的水化物可与其氢化物反应 | |
| C. | 最简单气态氢化物的热稳定性:Y<W | |
| D. | W、Z的氧化物都能与碱反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: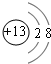 .
. .离子半径T3+<R3-(填“>”、“<”、“=”)
.离子半径T3+<R3-(填“>”、“<”、“=”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在纯氧中燃烧可生成SO3 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | SO2能使KMnO4溶液褪色 | |
| D. | CO2通入CaCl2溶液中能产生白色沉淀考点:考查S、SO2、CO2的性质以及鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com