

 ,
, .
.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、酸性氧化物:Na2O、CaO、CuO |
| B、碱:烧碱、纯碱、苛性钾 |
| C、盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ]
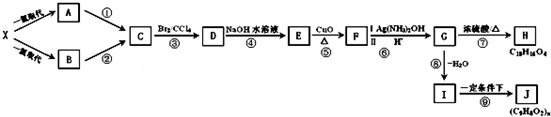
]
查看答案和解析>>
科目:高中化学 来源: 题型:
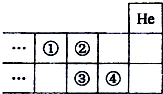
| A、①的气态氢化物比②的稳定 |
| B、②的最高价含氧酸的酸性比③强 |
| C、③的非金属性比④强 |
| D、④的原子半径比③小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
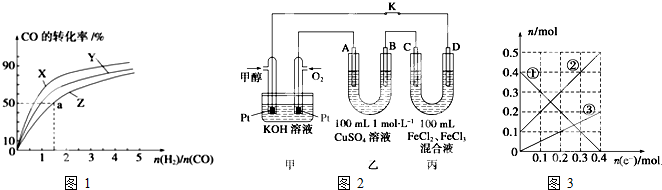
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
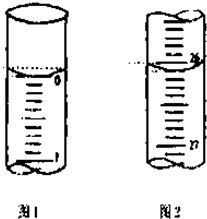 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol?L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | |
| 第二次 | 25.00 | 1.56 | 30.30 | |
| 第三次 | 25.00 | 0.22 | 26.31 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com