

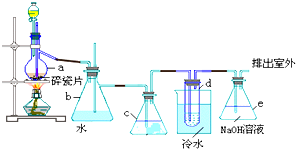
���� ��1��A�еķ�ͭм����������ϡ���ᷴӦ����������װ��CD����ˮ����װ�ã������������Ϊ���رյ��ɼУ���B������Aע������ϡ�����رգ���Ӧ���е�A�в��ٲ�������ʱ������Һ�ָ������º��ڼ���ƿ����Ͳ��Һ��߶���ƽ��ƽ����Ͳ�ڵ�Һ�棬����D��ˮ���������C���ռ���448mL���ѻ���ɱ�״��������Ϊ�������ʵ���Ϊ0.02mol��Fe+H2SO4=FeSO4+H2���������ʵ���Ϊ0.02mol������Ϊ0.02mol��56g/mol=1.12g������õ�ͭ����������ͭ������������
��2�����C��Dװ�ú��ɼУ�����������ͨ��A�У����ɵ��������ӱ������� ����������Ϊ�����ӣ������Ӻ�ͭ��Ӧ�����������ӣ���A�й���ȫ����ʧ��
��3����A����Һ�����ձ��ڣ�����Cu2��OH��2CO3���������pH=4ʱ����Һ��������ȫ���������˺ú��ɫ����������ͭ��Һ�����ݷ�Ӧ����ͷ�Ӧ��Ͳ��������д���ӷ���ʽ��
��4�����������Ϣ���òⶨ����������������ݳ������ⶨ��������������Ԫ������������õ�ͭ������������
��� �⣺��1��A�еķ�ͭм����������ϡ���ᷴӦ����������װ��CD����ˮ����װ�ã�������C��Һ���½���ˮ���ŵ�D�У������������Ϊ���رյ��ɼУ���B������Aע������ϡ�����رգ���Ӧ���е�A�в��ٲ�������ʱ������Һ�ָ������º��ڼ���ƿ����Ͳ��Һ��߶���ƽ��ƽ����Ͳ�ڵ�Һ�棬����D��ˮ���������C���ռ���448mL���ѻ���ɱ�״��������Ϊ�������ʵ���Ϊ0.02mol��Fe+H2SO4=FeSO4+H2���������ʵ���Ϊ0.02mol������Ϊ0.02mol��56g/mol=1.12g���÷�ͭм��ͭ�������ٷֺ���=$\frac{10g-1.12g}{10g}$��100%=88.8%��
�ʴ�Ϊ������Һ�ָ������º��ڼ���ƿ����Ͳ��Һ��߶���ƽ��88.8%��
��2�����C��Dװ�ú��ɼУ�����������ͨ��A�У��������ᷴӦ���ɵ������������ᱻ�����е���������Ϊ�������������Ӿ����������������ܽ�ͭ����A�й���ȫ����ʧ��Ӧ�����ӷ���ʽΪ��4Fe2++O2 +4H+=4Fe3++2H2O��2Fe3++Cu=2Fe2++Cu2+���ټ���ͨ��һ��ʱ������رյ��ɼУ�ֹͣͨ�������
�ʴ�Ϊ��4Fe2++O2 +4H+=4Fe3++2H2O��2Fe3++Cu=2Fe2++Cu2+��
��3����A����Һ�����ձ��ڣ�����Cu2��OH��2CO3���������pH=4ʱ����Һ��������ȫ���������˺ú��ɫ����������ͭ��Һ���˹������ӷ�Ӧ����ʽ��
Cu2��OH��2CO3+H++Fe3+=2Cu2++Fe��OH��3��+CO2����
�ʴ�Ϊ��Cu2��OH��2CO3+H++Fe3+=2Cu2++Fe��OH��3��+CO2����
��4�����ò������巨���������ݳ����������ⶨ������������������������Ԫ���������õ�ͭ�������������ͭм��ͭ�������ٷֺ���������ʵ�鷽��Ϊ���õ���������������ϴ�ӡ�������������㣬
�ʴ�Ϊ������3�������ú��ɫ����ϴ�ӡ�������������㣮
���� ���⿼�����������ʵ�̽��ʵ�鷽����ʵ����ƣ������������ʺ�ʵ�鷴Ӧԭ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| l | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �е�/�� | ˮ���� | |
| �״� | 65 | ���� |
| ��ȩ | -21 | ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K/L2•mol-2 | 4.1��106 | K1 | K2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com