
在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下SO2的转化反应的2SO2(g)+O2 (g) 2SO3(g)平衡常数K =532.4.
2SO3(g)平衡常数K =532.4.
下面三个混合体系中各物质的浓度如下表:
体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
(1) | 0.0600 | 0.400 | 2.000 | 不填 |
(2) | 0.0960 | 0.300 | 0.500 | 不填 |
(3) | 0.0862 | 0.263 | 1.020 | 不填 |
试判断各体系反应进行的方向:
体系(2) ;体系(3): (填正向、逆向或已平衡)。
科目:高中化学 来源:2016届江西南昌第二中学高三上第三次考试理综化学试卷(解析版) 题型:实验题
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料。某课外活动小组同学利用如图甲装置(固定装置略去)测定[Mg2Al(OH)6Cl•xH2O]的化学式,[Mg2Al(OH)6Cl•XH2O]高温下分解为MgO、Al2O3、HCl和水蒸气。

(1)装置连接后首先进行的操作是______________________________。
(2)将一定质量的[Mg2Al(OH)6Cl•xH2O]放在加热装置中充分加热,冷却后称量剩余固体的质量是131g,则其中MgO的质量是_______g。
(3)若只通过测定装置C、D的增重来确定x,加热前先通过N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2 。
①装置的连接顺序为a→ (用接口处的小写字母表示)。
②实验过程中装置C吸收HCl气体,没有用如图乙所示防倒吸装置的理由是_______________。
③完全分解后测得C增重3.65g、D增重9.90g,则x=______。
(4)下列实验方案也能测定x值的是 ,并且对不选方案说明不合理的理由:__________(若两个方案都选,此问就不作答)。
方案1:测定加热装置剩余固体的质量和装置D增重的质量
方案2:测定加热装置剩余固体的质量和装置C增重的质量
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2x(CO3)y • zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定下列数据中的 (填a、b、c等字母) 。
a.样品质量 b.样品分解后残余物质量 c.装置C的增重
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:推断题
下表是不同温度下水的离子积常数:
温度/℃ | 25 | T2 |
水的离子积常数 | 1×10-14 | 1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H8 D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:推断题
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
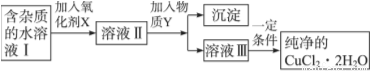
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同 时还产生的现象有_______。
时还产生的现象有_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:选择题
对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率
B.改变平衡混合物中某组分的百分含量
C.增大正反应速率,减小逆反应速率
D.以同样程度改变正逆反应的速率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数的数值,下列说法中错误的是
A.在标准状况下,22.4 L苯所含的碳原子数目为6NA
B.常温常压下,6.2g氧化钠含有的离子数为0.3NA
C.18 g 水所含的电子数目为10 NA
D.3.2g O2、O3混合物中所含S原子一定是0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
如下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH===2K2CO3+6H2O。

(1)甲池是________装置。
(2)乙池中A(石墨)电极的名称是________。
(3)写出通入CH3OH的电极的电极反应式:_________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况);此时丙池某电极上析出0.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NACl D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com