
����Ŀ����֪KMnO4��MnO2�����������¾��ܽ����� ��H2C2O4��������
�� i��MnO4��+H2C2O4+H+��Mn2++CO2��+H2O��δ��ƽ��
�� ii��MnO2+H2C2O4+2H+=Mn2++2CO2��+2H2O
ij�о�С��Ϊ�ⶨij���̿���MnO2������������ȷ��ȡ1.20g���̿���Ʒ������1.80g���ᣬ�ټ���������ϡ���Ტ���ȣ����ʲ��μӷ�Ӧ������ַ�Ӧ֮����ȴ����ȥ���ʣ���������Һת�Ƶ�����ƿ�в����ݣ�����ȡ��25.00mL����Һ������ƿ�У�����0.020molL��1KMnO4����Һ���еζ���������20.00mLKMnO4��Һʱǡ����ȫ��Ӧ���Իش��������⣺
�ٷ���ʽ�� i����ƽ��H2C2O4�ļ���ϵ��Ϊ ��
��0.020molL��1KMnO4����ҺӦ��������ס����ҡ����ζ����У��ζ��յ����ɫ�仯�� ��
�����ܷ�������о�С��������̿���MnO2�����������������ܡ������������������������˵��ԭ���ܡ��ļ�������ԭ��˵�� ��
������ʵ������д������в��������л�ʹ����MnO2����������ƫС���� ��
A���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ
B����Һת��������ƿ�У�δ���ձ�������ϴ��
C���ζ�ǰ���Ӷ������ζ����Ӷ���
D������ʱ�����ӿ̶���
E����ƿˮϴ֮��δ�ô���Һ��ϴ��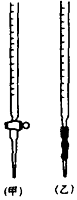
���𰸡�5���ף�����������һ��KMnO4��Һ����ƿ����Һ���������ɫ���Ұ���Ӳ���ɫ�����ﵽ�ζ��յ㣻����Ϊ��֪������ƿ�Ĺ��AD
���������⣺�ٷ�Ӧ��MnO4����Mn2+ �� ��Ԫ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ�H2C2O4��CO2 �� ̼Ԫ�ػ��ϼ���+3������Ϊ+4��������2�ۣ����ϼ���С������Ϊ10����MnO4��ϵ��Ϊ2��H2C2O4ϵ��Ϊ5���ٸ���Ԫ���غ��֪Mn2+ϵ��Ϊ2��CO2ϵ��Ϊ10�����ݵ���غ��֪H+ϵ��Ϊ16��������Ԫ���غ��֪H2Oϵ��Ϊ8����ƽ�����ӷ���ʽΪ2MnO4��+5H2C2O4+6H+=2Mn2++10CO2+8H2O�����Դ��ǣ�5���ڸ�����ؾ���ǿ�����ԣ�Ӧװ����ʽ�ζ����У�������ʽ�ζ��ܣ����Ǽ�ʽ�ζ��ܣ����������Ը�����ط���������ԭ��Ӧ�����ζ����յ�ʱ������ǡ����ȫ��Ӧ���ٵ���һ��KMnO4��Һ�����ɫ�����ɫ���Ұ���Ӳ���ɫ����˵���ﵽ�ζ��յ㣬���Դ��ǣ��ף�����������һ��KMnO4��Һ����ƿ����Һ���������ɫ���Ұ���Ӳ���ɫ�����ﵽ�ζ��յ㣻�����ڲ���������û�и�������ƿ�Ĺ���Ƕ��٣���֪�����Ƶ���Һ����������Դ��ǣ�����Ϊ��֪������ƿ�Ĺ�ܸ��ݷ�Ӧԭ�������ĵĸ�����ر�Һ���ƫ����������ĵIJ��������ƫ�����������ĵIJ�������ӻ�ƫС���ⶨ�Ķ������̵ĺ���ƫС�� A���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ���ζ�ǰ�����ݣ��ζ�ʱ���ĵĸ�����ر�Һ���ƫ�ⶨ�Ķ������̺���ƫ�ͣ���A��ȷ�� B����Һת��������ƿ�У�δ���ձ�������ϴ�ӣ�û��ϴ���ձ������������ᵼ�����Ƶ���Ʒ��Һ���������ʵ�����С���ζ������ĵĸ��������ҺƫС���ⶨ�Ķ������̵ĺ������ƫ�ߣ���B���� C���ζ�ǰ���Ӷ������ζ����Ӷ������ζ�ǰ���Ӷ�����������ƫ�ζ����Ӷ�����������ƫС�����ռ�����ƫС�����ĵĸ��������ҺƫС���ⶨ�Ķ������̺���ƫ�ߣ���C���� D������ʱ�����ӿ̶��ߣ��ᵼ�����Ƶ���Ʒ��Һ�����ƫС����Һ��Ũ��ƫ���ø��������Һ�ζ�ʱ�����ĵĸ��������Һ�����ƫ�ⶨ�Ķ������̺���ƫ�ͣ���D��ȷ�� E����ƿˮϴ֮��δ�ô���Һ��ϴ����ƿ����Ҫ��ϴ���˲�����ȷ���Եζ����û��Ӱ�죬��E�������Դ��ǣ�AD��
�����㾫����ͨ�������������к͵ζ��������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㼴���Խ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�������Һ��ͨ������������̼��������Ӧ��C6H5ONa+ CO2+ H2O�� C6H5OH+ NaHCO3���÷�Ӧ֤�������Ƶļ���ǿ��
A.����B.̼����C.̼������D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��������ᷴӦ��������NaOH��Ӧ����(����)
A. Na2CO3B. NaHSO4C. NaHCO3D. Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪KMnO4��MnO2�����������¾��ܽ����� ��H2C2O4��������
�� i��MnO4��+H2C2O4+H+��Mn2++CO2��+H2O��δ��ƽ��
�� ii��MnO2+H2C2O4+2H+=Mn2++2CO2��+2H2O
ij�о�С��Ϊ�ⶨij���̿���MnO2������������ȷ��ȡ1.20g���̿���Ʒ������1.80g���ᣬ�ټ���������ϡ���Ტ���ȣ����ʲ��μӷ�Ӧ������ַ�Ӧ֮����ȴ����ȥ���ʣ���������Һת�Ƶ�����ƿ�в����ݣ�����ȡ��25.00mL����Һ������ƿ�У�����0.020molL��1KMnO4����Һ���еζ���������20.00mLKMnO4��Һʱǡ����ȫ��Ӧ���Իش��������⣺
�ٷ���ʽ�� i����ƽ��H2C2O4�ļ���ϵ��Ϊ ��
��0.020molL��1KMnO4����ҺӦ��������ס����ҡ����ζ����У��ζ��յ����ɫ�仯�� ��
�����ܷ�������о�С��������̿���MnO2�����������������ܡ������������������������˵��ԭ���ܡ��ļ�������ԭ��˵�� ��
������ʵ������д������в��������л�ʹ����MnO2����������ƫС���� ��
A���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ
B����Һת��������ƿ�У�δ���ձ�������ϴ��
C���ζ�ǰ���Ӷ������ζ����Ӷ���
D������ʱ�����ӿ̶���
E����ƿˮϴ֮��δ�ô���Һ��ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�ʵ������ȡ����������Ũ����Ͷ������̷�Ӧ����������з�Ӧ��KClO3��6HCl��Ũ����KCl��3Cl2����3H2O���÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢������ȡ����������ѧ֪ʶ�ش��������⣺
��1��������Ӧ��____�����������÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ____��
��2��������ͨ����ɫʯ����Һ�У����Թ۲쵽�������ǣ�______________________��
��3��ʵ�������ƺ�2.0 mol��L-1��NaOH��Һ����Ҫ������Һ____mL������2.24 L��������״����ǡ����ȫ��Ӧ��
��4����֪Br2��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��NaBr��Һ�л���ͨ��Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ����д����Ӧ�����ӷ���ʽ______________��
��5������490 mL 2.0 mol��L-1 NaOH��Һ��
������������������ƹ����������____��
������ʵ����Ҫ����������ƽ�������룩��ҩ�ס��ձ�����Ͳ������������ͷ�ιܡ�______��
����������Һ�Ĺ����У����в���������ɽ��ƫ�ߵ���____��
A������ʱ����
B������ƿ�����������������ˮ
C���ܽ������ձ�δϴ��
D��NaOH�ܽ��δ��ȴ������ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡH2SO4��NaOH��AlΪԭ����ȡAl(OH)3, ���������ֲ�ͬ��;����
��: ![]()
��: ![]()
��: 
����ȡ������Al(OH)3��(����)
A. �ס������ĵ�ԭ��ͬ���� B. �����ĵ�ԭ������
C. �����ĵ�ԭ������ D. �������ĵ�ԭ��ͬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���һ����̼��ˮ����������������ȣ��ڴ��������·�����Ӧ��CO��g��+H2O��g��H2��g��+CO2��g������500��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02mol/L�����ڴ�������CO��ת����Ϊ�� ��
A.25%
B.50%
C.75%
D.80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ƾ�������ʳ���Ͳ����ľƾ��ijɷֲ���ȫ��ͬ���Ͻ��ù�ҵ�ƾ�����ʳ�þƣ������ʹ��˫Ŀʧ��������������ҵ�ƾ��е��ж��ɷ��ǣ� ��
A.CH3CH2OH
B.CH3COOC2H5
C.CH3OH
D.CH3COOCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��3CH4��g��+2N2��g��3C��s��+4NH3��g����H��0��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[ ![]() ]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� ��
]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� �� 
A.![]() Խ��CH4��ת����Խ��
Խ��CH4��ת����Խ��
B.![]() ����ʱ�������£�NH3���������������
����ʱ�������£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ26%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com