
分析 (1)依据反应焓变=反应物键能总和-生成物键能总和计算;
(2)依据热化学方程式,①2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol
②N2(g)+2O2(g)═2NO2 △H=+67.8kJ/mol
③3H2(g)+N2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律计算所需热化学方程式为[(②-③)×2-①×3]×$\frac{1}{4}$计算得到;
(3)根据原子经济分析,反应是原材料分子中的原子全部转变成所需产物,不产生副产物,实现零排放;
解答 解:(1)实验测得1mol H2与1mol Cl2完全反应放出184.6kJ的热量,又知1mol H2分子中化学键断裂时需要吸收436kJ的能量,1mol Cl2分子中化学键断裂需要吸收243kJ的能量,1mol HCl分子中化学键断裂时需要吸收能量x,反应焓变=反应物键能总和-生成物键能总和,-184.6KJ/mol=436KJ/mol+243KJ/mol-2x,x=431.8KJ/mol
则1mol HCl分子中化学键断裂时需要吸收431.8kJ,
故答案为:431.8kJ;
(2)①2H2O(g)═2H2(g)+O2(g);△H=+483.6kJ/mol
②N2(g)+2O2(g)═2NO2;△H=+67.8kJ/mol
③3H2(g)+N2(g)═2NH3(g);△H=-92.0kJ/mol
[(②-③)×2-①×3]×$\frac{1}{4}$得到NH3(g)+$\frac{7}{4}$O2(g)═NO2 +$\frac{3}{2}$H2O(g)△H=-282.8kJ/mol;
则1mol NH3(g)燃烧生成NO2(g)和H2O(g)的反应热△H=-282.8kJ/mol;
故答案为:-282.8kJ/mol;
(3)理想的原子经济性反应是原材料分子中的原子全部转变成所需产物,不产生副产物,实现零排放.原子利用率是指反应物中的所有原子进入期望产物中的百分比,绿色化学的特征之一是提高原子用率,尽量达到100%,根据原子经济,可知最终反应为:2H2O═2H2↑+O2↑,根据盖斯定律将(①+②+③)×2+④,可知反应③为HgBr2+CaO$\frac{\underline{\;250℃\;}}{\;}$HgO+CaBr2;该方法中需要750℃,消耗能量高,且有重金属污染,
故答案为:HgBr2+CaO$\frac{\underline{\;250℃\;}}{\;}$HgO+CaBr2;循环过程需要很高的能量,且使用重金属汞,产生污染.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用,注意利用键能计算焓变的方法,掌握基础是关键,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体 | |
| B. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| C. | 水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染 | |
| D. | 牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$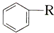 +HCl
+HCl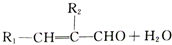
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列各小题.
完成下列各小题. 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1mol CaC2、KHSO4、Na2O2三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 1molCu和足量热浓硫酸反应可生成nA个SO3分子 | |
| C. | 3mol单质Fe完全转变为Fe3O4,失去8nA个电子 | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+ 的物质的量浓度为1mol•L-1 | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 常温下,1L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 除去FeCl2溶液中少量的FeCl3,可加入过量的铁粉,完全反应后过滤 | |
| C. | 用渗析的方法可除去Fe(OH)3胶体中混有的Cl- | |
| D. | 加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| 甲 | 物质 | 构成物质微粒 | 金属元素 | 化学反应 |
| 乙、丙 | 混合物、纯净物 | 分子、原子、离子 | 铜、碳、氖 | 化合反应 分解反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com