
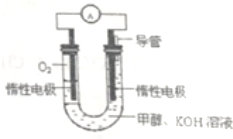
 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.分析 该燃料电池中,电解质溶液呈碱性,通入甲醇的一极为负极,燃料失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,通入氧气的电极为正极,电极反应式为O2+4e-+2H2O═4OH-,结合原电池的工作原理解答该题.
解答 解:(1)氧气具有氧化性,通入空气的一极为正极,发生还原反应,电极方程式为,负极发生氧化反应,电极方程式为,
故答案为:正;O2+4e-+2H2O═4OH-;CH3OH-6e-+8OH-═CO32-+6H2O;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动,正极发生O2+4e-+2H2O═4OH-,则正极附近溶液的pH 增大,
故答案为:负;增大;
(3)燃料电池把化学能转变成电能,对环境影响很小,燃料直接燃烧会对环境造成污染.故答案为:污染少.
点评 本题考查了化学电源新型电池,为高考常见题型,侧重于学生的分析能力的考查,题目侧重考查燃料电池的考查类型主要有电极反应式、电池反应式的书写、正负极的判断等,书写电极反应式时注意:原料相同,若电解质溶液不同,电极反应式就不同.


科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 146C和167N的质子数相同,中子数不同 | |
| B. | 2814Si和2914Si的质子数相同,是同一种核素 | |
| C. | Na和K属于IA族元索,Na的金属性比K弱 | |
| D. | Cl和Br属于ⅧA族元素,两原子核外电子数之差为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com