
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl===NaCl+H2O;B.Zn+H2SO4===ZnSO4+H2↑。
判断能否设计成原电池A__________,B__________(填“能”或“不能”)。
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
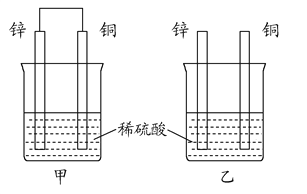
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
【答案】 不能 能 BD > Zn-2e-===Zn2+ 1 mol·L-1
【解析】(1)原电池中发生的是自发的氧化还原反应,A.为酸碱中和,是非氧化还原反应,故不能设计成原电池;B.是置换反应,是氧化还原反应,能设计成原电池;
(2)①甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀;A.甲是化学能转变为电能的装置,乙不是,故A错误;B.乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确;C.甲、乙中锌片质量都减少,故C错误;D.两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确;故选BD;
②原电池原理引起的腐蚀速度大于化学腐蚀的速度;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+;
④释后氢离子的物质的量为1L×0.1molL-1=0.1mol,生成氢气的氢离子的物质的量为![]() ,所以原溶液中氢离子的物质的量为0.2mol,原溶液中氢离子的浓度为
,所以原溶液中氢离子的物质的量为0.2mol,原溶液中氢离子的浓度为![]() =2mol/L,一个硫酸分子中含两个氢离子,所以原溶液中稀硫酸的浓度为1 molL-1。
=2mol/L,一个硫酸分子中含两个氢离子,所以原溶液中稀硫酸的浓度为1 molL-1。


科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是
A.C3H6、C2H4 B.C2H6、C2H6O C.C2H4、C2H6O D.C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。

(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·江苏化学,14,4分)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH![]() )=c(HCO
)=c(HCO![]() )+c(CO
)+c(CO![]() )
)
B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH![]() )>c(SO
)>c(SO![]() )
)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)]
)+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·江苏化学,13,4分)根据下列实验操作和现象所得到的结论正确的是(双选)( )
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1 mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。 | HSO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
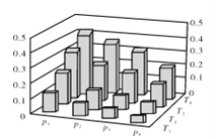
A.P1>P2>P3>P4
B.若T1> T2> T3>T4,则该反应为放热反应
C.甲醇的物质的量分数越高,反应的平衡常数越大
D.缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中可发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com