
已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
科目:高中化学 来源: 题型:
| ||
| 800℃.Al |
|
|
|
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)(1)1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 。
(2)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
![]()
已知:①C(s)+ O2(g) = CO2(g);ΔH=-393.5kJ/mol
②2CO(g) + O2(g) = 2CO2(g);ΔH=-566kJ/mol
③TiO2(s) + 2Cl2(g)= TiCl4(s)+O2(g);ΔH=+141kJ/mol
则a.碳在氧气中不完全燃烧生成CO的热化学方程式为
。
b.TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(s) + 2CO(g)的ΔH=________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明一中高二第一次月考化学试卷(带解析) 题型:填空题
(5分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3).已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
查看答案和解析>>
科目:高中化学 来源:2010年山西省高二上学期10月考化学 题型:填空题
由金红石(TiO2)制取单质Ti,涉及的步骤为: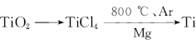
已知:①C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g) ====2CO2(g) ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) ====TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则(1)TiO2(s)+2Cl2(g)+2C(s) ====TiCl4(s)+2CO(g)的ΔH=____________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:山西省模拟题 题型:填空题
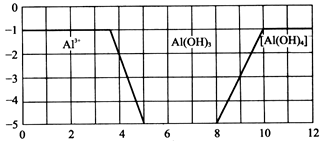
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com