
下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液)
B.NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液)
C.NaBr、Na2CO3、KI、CaCl2(AgNO3溶液)
D.NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液)
科目:高中化学 来源: 题型:
下列实验操作正确的是
A. 实验室制取蒸馏水的实验,将温度计水银球插入自来水中
B. 分液时,分液漏斗下层液体先从下口放出,上层液体再从下口放出
C. 浓NaOH溶液溅到皮肤上,立即用大量水冲洗,然后涂上稀硼酸溶液
D. 配制硫酸溶液时,可先在量筒中加入一定体积的水,边搅拌边慢慢注入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有以下四种物质:
A.新制的氢氧化铜[Cu(OH)2]悬浊液
B.碳铵(NH4HCO3)
C.明矾[KAl(SO4)2·12H2O]
D.熟石灰[Ca(OH)2]
请你根据题意,选择恰当的选项用字母代号填空:
①检验尿液中是否含有葡萄糖,可使用 ;
②要使含泥沙的洪水变澄清,可使用 ;
③要中和钢铁厂、电镀厂产生的酸性废水,可使用 ;
④给农作物施用氮肥,可使用 。
(2)2013年1月,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是 (填字母)。
a.SO2 b.NO2 c.PM2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不可行或结论不正确的是
A.用润湿的pH试纸测定饱和Na2CO3溶液pH
B.通过观察右图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.相同温度下,向同浓度、同体积的醋酸和盐酸溶液中加入足量镁粉,比较同一时间产生H2的快慢来比较两种酸的强弱

查看答案和解析>>
科目:高中化学 来源: 题型:
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:

 已知:①Ksp[Mg(OH)2]=6.0×10—12
已知:①Ksp[Mg(OH)2]=6.0×10—12
②Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.
③三种化合物的溶解度(S)随温度变化的曲线如右图所示。
(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是 。
(2)若溶液中Mg2+浓度为6.0mol•L-1,则溶液pH≥ 8
才能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4•2H2O溶解度小等合理答案均可),所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为:
①向滤液Ⅱ中加入 NaOH溶液
; ②过滤,得沉淀并洗涤;
③ 向沉淀中加足量稀硫酸
;
④蒸发浓缩,降温结晶; ⑤过滤、洗涤得产品。
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为 20.0%
(MgSO4•7H2O的相对分子质量为246)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是
A.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液。营养液中部分离子的物质的量浓度如图所示。若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)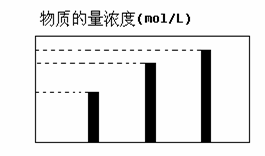
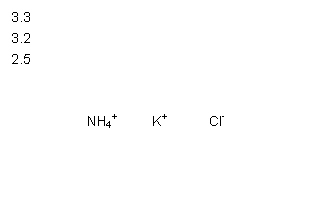 ( )
( )
A.2、64、24 B.16、50、24
C.32、50、12 D.64、2、24
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子核外电子排布式 。
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac— = CH3COO—),其反应是:
[Cu(NH3)2] Ac +CO+NH3  [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为 。
②[Cu(NH3)2]+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
③氨分子中N原子的杂化方式为 。
 (3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
(3)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃, MgO的熔
点高达2800℃。造成两种晶体熔点差距的主要原因是 。
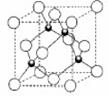
(4)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、
CuH等。右图是铜的一种氯化物晶体的晶胞结构,则它的化学式是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com