
| A. | 只有① | B. | 只有①② | C. | 除了③ | D. | 除了④ |
分析 ①钠和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成红褐色沉淀;
②过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和CuSO4反应生成氢氧化铜沉淀;
③电石和水反应生成氢氧化钙和乙炔气体,氢氧化钙和碳酸氢钠反应生成沉淀碳酸钙;
④少量的Na2O与水反应生成少量的氢氧化钠,少量的氢氧化钠和明矾反应生成氢氧化铝沉淀,无气体生成.
解答 解:①钠和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成红褐色沉淀,2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl,故①符合;
②Na2O2投入CuSO4溶液发生反应,2Na2O2+2H2O=4NaOH+O2↑,CuSO4+2NaOH=Cu(OH)2↓+2NaCl;故②符合;
③过量CaO投入少量NH4HCO3溶液中发生的反应为:CaO+H2O=Ca(OH)2、Ca(OH)2+NH4HCO3=CaCO3↓+2H2O+NH3↑,故③符合;
④少量的Na2O与水反应生成少量的氢氧化钠,少量的氢氧化钠和明矾反应生成氢氧化铝沉淀,无气体生成,故④不符合;
综上所述:①②③正确;
故选D.
点评 本题考查了钠及其化合物的性质应用,题目难度一般,主要考查反应生成沉淀和气体的判断,掌握物质发生的化学反应是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠溶液中加入氢氧化钠溶液:H++OH-=H2O | |
| B. | 氧化铜和稀盐酸:CuO+2H+=Cu2++H2O | |
| C. | 少量的NaHCO3与足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 少量的NaHCO3溶液与足量的Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、[Al(OH)4]? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SCN? | |
| D. | 加入铝粉能放出氢气的溶液中能大量存在K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
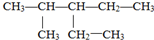 的名称是2-甲基-3-乙基戊烷;
的名称是2-甲基-3-乙基戊烷;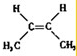 ;
;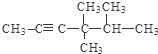 .
.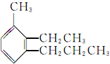 的系统名称为3-甲基-2-乙基丙苯.
的系统名称为3-甲基-2-乙基丙苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 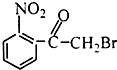 | B. | 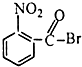 | C. | 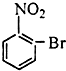 | D. | 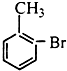 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③ | C. | ①②④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com