
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
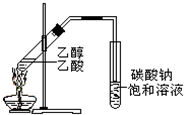 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白色沉淀是CuI2,棕色溶液含有I2 |
| B、滴加KI溶液时,转移2mol e-时生成1mol白色沉淀 |
| C、通入SO2时,SO2与I-反应,I-作还原剂 |
| D、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2的浓度不变 |
| B、沉淀溶解后,深蓝色的溶液为[Cu(NH3)4](OH)2 |
| C、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子NH3提供空轨道 |
| D、用硝酸铜溶液代替硫酸铜溶液进行实验,能观察到同样的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
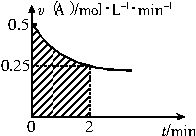 某溶液中发生反应A
某溶液中发生反应A| 无 |
| 无 |
| A、反应开始的前2min,A的平均反应速率小于0.375mol?L-1?min-1 |
| B、图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值 |
| C、图中阴影部分的面积表示0~2min内A的物质的量的减小值 |
| D、至2min时,B的物质的量浓度c(B)介于1~1.5mol?L-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
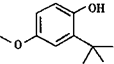
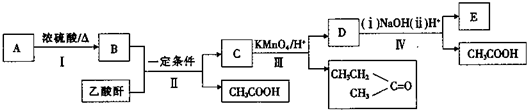
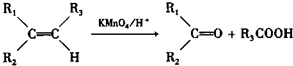
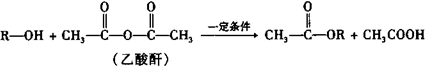
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com