
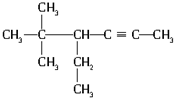
 的系统名称为
的系统名称为 含有官能团碳碳三键,含有碳碳三键最长的碳链含有6个C,主链为己炔,编号从距离三键最近的一端右边开始编号,官能团碳碳三键在2号C,表示为:”2-戊炔“取代基甲基在4、5、5号C上,称为“5,5-二甲基-4-乙基”,该炔烃的正确命名为:5,5-二甲基-4-乙基-2-戊炔,
含有官能团碳碳三键,含有碳碳三键最长的碳链含有6个C,主链为己炔,编号从距离三键最近的一端右边开始编号,官能团碳碳三键在2号C,表示为:”2-戊炔“取代基甲基在4、5、5号C上,称为“5,5-二甲基-4-乙基”,该炔烃的正确命名为:5,5-二甲基-4-乙基-2-戊炔,

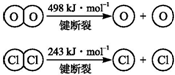
科目:高中化学 来源: 题型:
| ||
| 400℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
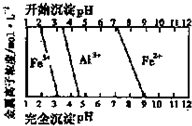 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.
| 微粒平衡 | 平衡常数 |
| FeCO3(a)?Fe2+(aq)+CO32-(aq) | Kap=3.2×10-11 |
| H2CO3?H++HCO3- | Ka1=4.36×10-7 |
| HCO3-?H++CO32- | Ka2=4.68×10-11 |
| 2HCO3-?H2CO3+CO32- | K=1.3×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
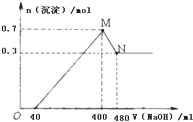 (1)将7.8克过氧化钠投入到100克10%的苛性钠溶液中充分反应.反应的离子方程式为:
(1)将7.8克过氧化钠投入到100克10%的苛性钠溶液中充分反应.反应的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 密度(g/ml-3) | 沸点(℃) | 水溶性 | 溶解性 |
| 甲 | 0.893 | 68.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
| A、蒸馏 | B、渗析 | C、萃取 | D、重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类物质是绿色植物光合作用产物,是动植物所需能量的来源 |
| B、葡萄糖可用于医疗输液 |
| C、蔗糖主要存在于甘蔗和甜菜中 |
| D、对纤维素对人体来说,可有可无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com