
| A. | 常温常压下,8.0gCH4中含有的氢原子数为NA | |
| B. | 1mol氯气跟水完全反应,转移的电子数为2NA | |
| C. | 1 molNa2O2跟足量CO2完全反应,转移的电子数为NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
分析 A.质量转化为物质的量,结合1个甲烷分子含有4个氢原子解答;
B.氯气与水反应为歧化反应,且为可逆反应;
C.Na2O2与CO2的反应是歧化反应;
D.溶液体积未知.
解答 解:A.常温常压下,8.0gCH4中含有的氢原子数为$\frac{8.0g}{16g/mol}$×4×NA=2NA,故A错误;
B.在Cl2+H2O?HCl+HClO这个反应中,发生氯气自身的氧化还原反应,而且氯气没有完全反应,所以1mol氯气参加反应转移电子数小于NA,故C错误;
C.Na2O2与CO2的反应是歧化反应,1mol Na2O2与足量的CO2反应转移1mol电子,个数为NA,故C正确;
D.溶液体积未知,依据n=CV可知无法计算.1mol/L MgCl2溶液中含氯离子数目,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,注意明确标况下气体摩尔体积的使用条件,掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系是解题关键,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 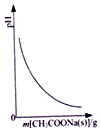 图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 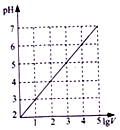 图表示0.1LpH=2的HC1溶液加水稀释至VL,pH随lgV的变化 | |
| C. | 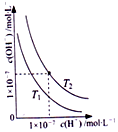 图表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1 | |
| D. | 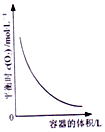 图表示同一温度下,再不同容积的容器中进行反应2BaO2(s)?2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白液漂洗衣物:H2O+2NaClO+CO2═2HClO+CO32-+2Na+ | |
| B. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq) | |
| C. | 用氢氧化钠溶液处理工业含二氧化硫的尾气:SO2+2OH-═HSO3-+H2O | |
| D. | 用加少量铁粉的方法存放硫酸亚铁溶液:Fe3++Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+具有氧化性,可用KSCN溶液鉴别Fe3+ | |
| B. | H+、Na+、Fe2+、MnO4-在水溶液中不能大量共存 | |
| C. | 磁性氧化铁溶于稀硝酸的离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 将水蒸气通过灼热的铁粉,粉末变红,说明铁与水蒸气在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ④⑤ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 7.8g过氧化钠与足量水反应,转移电子数为0.2NA | |
| C. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| D. | 100mL0.1mol/L的Na2SO4溶液中,所含离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 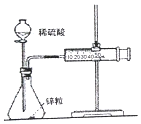 图中测定锌粒与1 mol•L-1 稀硫酸的反应速率,只需测定注射器中收集氢气的体积 | |
| B. | 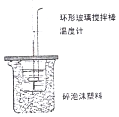 图 装置中进行50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1 NaOH 溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1 mol 水的热量 | |
| C. | 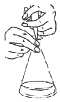 图 酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁 | |
| D. | 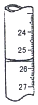 图滴定管中液面位置如图所示,则此时的读数为26.50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SiF4)消耗=4v(HF)生成 | B. | HF 的体积分数不再变化 | ||
| C. | 容器内气体压强不再变化 | D. | 容器内气体总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀 | |
| B. | 向0.1 mol•L-1 CH3COONa溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 一定温度下,增大反应2BaO2(s)?2BaO(s)+O2(g)容器的体积,平衡不移动 | |
| D. | 反应TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H>0能自发进行,其原因是△S>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com