
为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L?1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L?1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L?1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L?1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L?1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将 与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L?1 FeCl3溶液中,Fe3+的氧化性比H+更强。
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)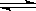 2C(g),若反应开始时充入2mol A和1mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是
2C(g),若反应开始时充入2mol A和1mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是
A.3mol C B.0.5mol A、1.5mol B和1.5molC
C.1mol B和1mol C D.1mol A、0.5mol B和1mol C
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:选择题
不同温度下,水溶液中c(H+)与c(OH﹣)关系如图所示.下列说法正确的是( )
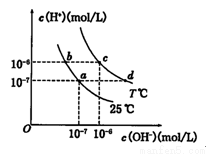
A.a点对应的溶液中大量存在:Na+、Mg2+、Cl﹣、SO42﹣
B.b点对应的溶液中大量存在:Fe2+、Ba2+、Cl﹣、NO3﹣
C.c点对应的溶液中大量存在:K+、Al3+、Cl﹣、CO32﹣
D.d点对应的溶液中大量存在:Na+、NH4+、ClO﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示。下列有关说法正确的是
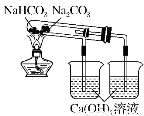
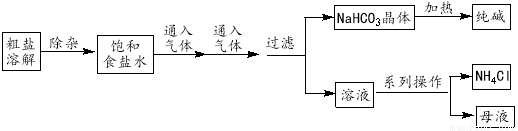
A.对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B.饱和食盐水中先通入的气体为CO2
C.流程图中的“系列操作”若在实验室中进行,一定需要玻璃棒
D.如图所示装置可以比较Na2CO3和Na HCO3晶体的热稳定性
HCO3晶体的热稳定性
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
下列说法正确的是
A.食用植物油属于人体所需的三大营养物质之一
B.分馏、干馏都是物理变化,裂化、裂解都是化学变化
C.淀粉、蛋白质、葡萄糖都是高分子化合物
D.甲烷、汽油、生物柴油、酒精都是碳氢化合物,均可作为燃料
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)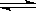 CH3OH(g) ∆H1=?90.1kJ·mol?1
CH3OH(g) ∆H1=?90.1kJ·mol?1
ii.2CH3OH(g)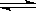 CH3OCH3(g)+H2O(g) ∆H2=?24.5kJ·mol?1
CH3OCH3(g)+H2O(g) ∆H2=?24.5kJ·mol?1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
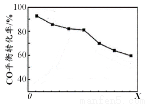
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3?) + c(OH?)
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:实验题
利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂【主要成分为Al(OH)2Cl】的一种工艺如下:
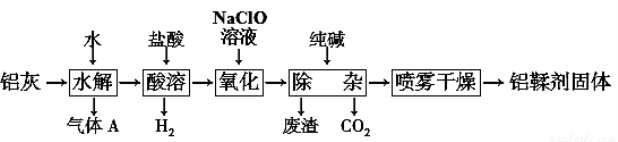
⑴气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为: 。
⑵“酸溶”时,Al2O3发生反应的离子方程式为: 。
⑶“氧化”时,发生反应的离子方程式为: 。
⑷“废渣”成分为________(填化学式)。
⑸采用喷雾干燥而不用蒸发的原因是______________________。
⑹煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]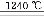 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
将产生的气体通过如下图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
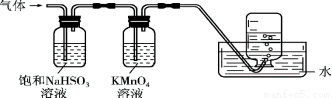
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.34gH2O2中含有的阴离子数为1NA
B.4.6g乙醇中含有的C-H键的个数为0.6NA
C.标准状况下,VL水含有的氧原子个数约为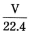
D.1molFe2+与足量的H2O2溶液反应,转移NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com