
分析 (1)在高温下,硫铁矿的粉末与氧气充分反应生成氧化铁和二氧化硫;再利用质量守恒定律中的原子在化学反应前后数目不变来配平;
(2)浓硝酸不稳定,在见光或受热时分解生成二氧化氮、氧气和水.
解答 解:(1)FeS2煅烧制备二氧化硫,反应物为FeS2、O2,生成物为Fe2O2、SO2,:FeS2+O2→Fe2O2+SO2,利用“定一法”,把氧化铁的计量数定为1,则先配铁,再配硫,再配氧元素,则:2FeS2+$\frac{11}{2}$O2$\frac{\underline{\;高温\;}}{\;}$Fe2O3+4SO2,则去分母,可得:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O2+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O2+8SO2;
(2)浓硝酸不稳定,在见光或受热时分解生成二氧化氮、氧气和水,反应方程式为:4HNO3(浓)$\frac{\underline{\;见光或受热分解\;}}{\;}$4NO2↑+O2↑+2H2O,
故答案为:4HNO3(浓)$\frac{\underline{\;见光或受热分解\;}}{\;}$4NO2↑+O2↑+2H2O.
点评 本题考查了化学方程式的书写,掌握化学方程式的书写方法和对反应原理的理解应用是解答的关键,题目难度不大,注意用硫铁矿(FeS2)煅烧制备二氧化硫配平技巧.


科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
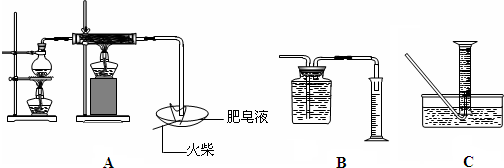
| 现象 | 结论与解释 | |
| 可能① | ||
| 可能② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水出现水质污染物邻叔丁基苯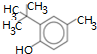 的分子式是C11H16O 的分子式是C11H16O | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 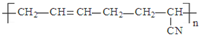 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
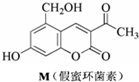
| A. | M与Br2可以发生取代反应,但不能发生加成反应 | |
| B. | M既能与FeCl3发生显色反应,也能与CH3COOH发生反应 | |
| C. | 1molM最多消耗3mol NaOH | |
| D. | 1molM在催化剂作用下最多能与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
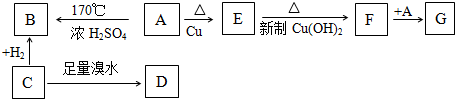
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com