
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
【答案】A
【解析】
根据题中假设12C的相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),实际上是把作为相对原子质量的标准从原来用12C质量的![]() ,改为
,改为![]() ,但是单个碳原子的质量并没有因此而发生改变;原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),则阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),据此进行分析。
,但是单个碳原子的质量并没有因此而发生改变;原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),则阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),据此进行分析。
A.摩尔质量的单位是gmol﹣1,在数值上等于其相对分子质量,假如12C相对原子质量为24,则O的相对原子质量为32,故二氧化碳相对分子质量是88,其摩尔质量是88gmol﹣1,A项正确;
B.气体摩尔体积是指在一定的温度和压强下,阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积也是原来的2倍,则可知标准状况下,Vm约为44.8L/mol,又此时CO2的摩尔质量为88gmol﹣1,则根据关系式![]() 可知,标况下标准状况下44gCO2体积约为
可知,标况下标准状况下44gCO2体积约为![]() ,B项错误;
,B项错误;
C.据题意可知,CO2与CO的摩尔质量分别为88gmol﹣1、56 gmol﹣1,根据关系式![]() ,可知44gCO2与28gCO所具有的原子数分别为
,可知44gCO2与28gCO所具有的原子数分别为![]() 、
、![]() ,44gCO2与28gCO所具有的原子数不同,C项错误;
,44gCO2与28gCO所具有的原子数不同,C项错误;
D.题中没有注明微粒为原子还是分子,指代不明确,D项错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料 — 铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 _______,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 _____________。
(2)“酸浸”过程中“,酸浸铁”发生反应的离子方程式是 ______________。
(3)明矾净水的原理是 _____________(用离子方程式表示)。
(4)检验滤液 A 中是否存在 Fe2+ 的实验操作是 __________________。
(5)在滤液 A 中加入高锰酸钾溶液的目的是 ________________(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(6)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____________。
(7)操作Ⅱ是 ___________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.1mol物质均约含有6.02×1023个分子B.6.02×1023个氢分子就是1mol H2
C.1gH2与1mol H2所含分子数相等D.1mol H2O与1molH2SO4的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
B. 物质的量浓度为0.5mol/LAlCl3溶液中,含有Cl-个数为1.5NA
C. 6g乙烷中含有的共价键的数目为1.4NA
D. l mol甲基(- CH3)所含电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJmol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
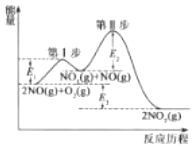
①第I步反应的热化学方程式为__。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)N2(g)+2H2O(g)。研究表明:某温度时,v正=kcm(NO)cn(H2),其中k=2.5×103mol(m+n-1)L(m+n-1)s-1.该温度下,当c(H2)=4.0×10-3molL-1时,实验测得v正与c(NO)的关系如图一所示,则m=___,n=___。
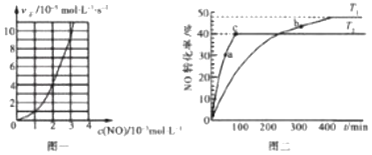
(3)NO易发生二聚反应2NO(g)N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__(任写一条即可)。
③a、b处正反应速率va__vb(填”>”“<”或“=”),原因为___。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___kPa-1(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
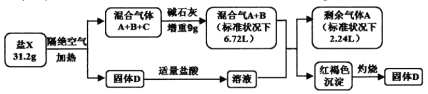
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2.2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是( )
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 若它变成1 mol C5H12至少需要2 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com