
| 1 |
| 2 |
| 3.6g |
| 18g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| A、27g铝的原子最外层电子总数为NA |
| B、2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| C、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| D、标准状况下,22.4L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ |
| B、FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
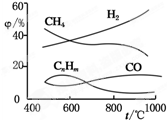 我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )
我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )| A、煤只含有碳、氢、氧三种元素 |
| B、煤中所含的有机物是CH4、CnHm、CO |
| C、温度在580~600℃范围内,CH4、CnHm分解不会生成CO |
| D、800℃以后CnHm分解生成了甲烷和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
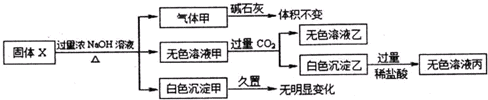
| A、气体甲一定是纯挣物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 |
| D、将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
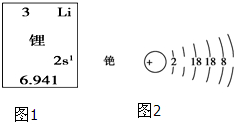 碱金属元素在科学研究与生产生活中有着非常广泛的用途.
碱金属元素在科学研究与生产生活中有着非常广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率ν(Z)=0.04mol?L-1?min-1 |
| B、其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) |
| C、该温度下此反应的平衡常数K=90L/mol |
| D、其他条件不变,再充入0.2molZ,平衡时X的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①③ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com