
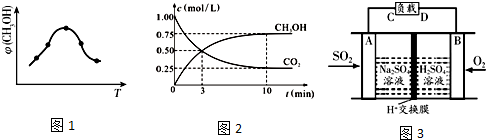
分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②先根据图表,利用v=$\frac{△c}{△t}$计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)①SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
②硝酸铵溶液中滴加适量的NaOH溶液溶液的pH=7,则氢离子和氢氧根离子浓度相等,根据电荷守恒来计算.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律(①+②)×$\frac{1}{2}$得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=$\frac{C(C{H}_{3}OH)×C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$,
故答案为:<;$\frac{C(C{H}_{3}OH)×C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),第10min后,向该容器中再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大,
故答案为:0.225;变大;
(3)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-,
故答案为:SO2-2e-+2H2O=4H++SO42-;
②常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,溶液中电荷守恒c(H+)+c(NH4+)=c(NO3-)+c(OH-),c(H+)=c(OH-),溶液的pH=7,
故答案为:=.
点评 本题考查较为全面,涉及热化学方程式的计算、化学平衡常数表达式的书写、电化学知识等知识,为高考高频考点,掌握反应热计算的方法、电化学原理尤为重要,题目难度中等.


科目:高中化学 来源: 题型:选择题
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| D. | 2.3g金属钠全部变成钠离子时失去的电子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
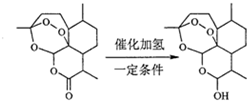
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com