
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 任何纯净物都是有一种元素组成的 | |
| C. | 含有氧元素的化合物一定是氧化物 | |
| D. | 有不同种元素组成的纯净物是化合物 |
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物.氧气和臭氧组成的混合物由一种元素组成,不是单质;纯净物不一定由同种分子构成,还可能由同种原子构成;分解反应一定有单质生成,例如碳酸分解生成二氧化碳和水,没有单质;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.
解答 解:A.由一种元素组成的物质不一定是单质,如氧气和臭氧组成的混合物由一种元素组成,是混合物不是单质,故A错误;
B.纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物,故B错误;
C.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,含氧酸、含氧酸盐等都含氧元素,故C错误;
D.由两种或两种以上的元素组成的纯净物叫化合物,故D正确;
故选D.
点评 本考点考查了物质的分类,物质组成等.要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g/mol | |
| B. | 2 mol H2O和2 mol NH3含电子数相同 | |
| C. | 等质量的O2和O3中所含氧原子个数不同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电泳实验证明胶体带电 | |
| B. | 通常利用丁达尔效应区别溶液与胶体 | |
| C. | 过滤实验说明胶体粒子不能透过滤纸 | |
| D. | 向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 编号 | C(H2)mol/L | C(CO)mol/L |
| 甲 | 2 | 1 |
| 乙 | 1 | 2 |
| 丙 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
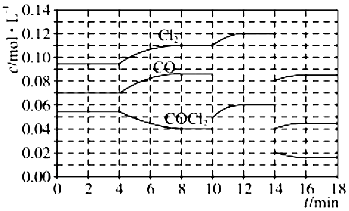 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制得金属镁 | |
| C. | 在海轮的外壳镶上锌块,可减缓船体的腐蚀速率 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com