

| CH3COOH | HClO | H2CO3 |
| Ka=1.8”Į10-5 | Ka=3£®0”Į10-8 | Ka1=4£®4”Į10-7 Ka2=4£®7”Į10-11 |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| Ėį | c(Ņ»ŌŖĖį) /mol”¤LØC1 | c(NaOH) /mol”¤LØC1 | »ģŗĻČÜŅŗµÄpH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 H+ + A2- £ØKa=1.0”Į10-2£©£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
H+ + A2- £ØKa=1.0”Į10-2£©£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż |
| ČÜŅŗ | °±Ė® | ĒāŃõ»ÆÄĘ | “×Ėį | ŃĪĖį | “×ĖįÄĘ |
| pH | 11 | 11 | 3 | 3 | 8.3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Éś³ÉĮĖŅ»ÖÖĒæĖįČõ¼īŃĪ | B£®ČõĖįČÜŅŗŗĶĒæ¼īČÜŅŗ·“Ó¦ |
| C£®ĒæĖįČÜŅŗŗĶČõ¼īČÜŅŗ·“Ó¦ | D£®Ņ»ŌŖĒæĖįČÜŅŗŗĶŅ»ŌŖĒæ¼īČÜŅŗ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĻņøĆČÜŅŗÖŠ¼ÓĖ®Ļ”ŹĶ£ŗc(OH”Ŗ)/c(NH3”¤H2O )Ōö“ó |
| B£®0.lmol/L°±Ė®Óė0.lmol/LH2SO4ČÜŅŗµČĢå»ż»ģŗĻŗóĖłµĆČÜŅŗÖŠ£ŗc(NH4+)+c(H+)£½2c(SO42”Ŗ)+c(OH”Ŗ) |
| C£®0.1mol/L°±Ė®Óė0.05mol/LHClČÜŅŗµČĢå»ż»ģŗĻŗóĖłµĆČÜŅŗÖŠ£ŗc(NH4+)+n(NH3)+n(NH3”¤H2O)£½2n(Cl”Ŗ) |
| D£®ÅØ¶Č¾łĪŖ0.1mol/L°±Ė®ŗĶNH4ClČÜŅŗµČĢå»ż»ģŗĻŗó£¬ČōČÜŅŗ³Ź¼īŠŌ£¬Ōņ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŠĀÖĘĀČĖ®ÓėĢ¼ĖįĒāÄĘ²»·“Ó¦ |
| B£®25”ꏱ£¬0.1mol/LµÄ“×ĖįČÜŅŗÓė0.01mol/LµÄ“×ĖįČÜŅŗÖŠ£¬KaĒ°Õߊ”ÓŚŗóÕß |
| C£®NaClOČÜŅŗÖŠĶØČėÉŁĮ涞Ńõ»ÆĢ¼µÄ·“Ó¦ĪŖ£ŗ2NaClO+CO2+ H2O = Na2CO3 +2HClO |
| D£®µČĪļÖŹµÄĮæÅØ¶ČµÄĢ¼ĖįÄĘČÜŅŗ”¢“×ĖįÄĘČÜŅŗ”¢“ĪĀČĖįÄĘČÜŅŗµÄpH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
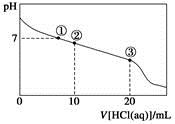
| A£®µć¢ŁĖłŹ¾ČÜŅŗÖŠ£ŗc(CH3COOH)£½c(Cl£)£¾c(OH£)£½c(H£«) |
| B£®µć¢ŚĖłŹ¾ČÜŅŗÖŠ£ŗc(Na£«)£¾c(Cl£)£¾c(CH3COO£)£¾c(CH3COOH) |
| C£®µć¢ŪĖłŹ¾ČÜŅŗÖŠ£ŗc(CH3COOH)£¾c(Na£«)£¾c(H£«)£¾c(CH3COO£) |
| D£®Õūøö¹ż³ĢÖŠæÉÄܳöĻÖ£ŗc(H£«)£«c(Na£«)£½c(CH3COOH)£«c(CH3COO£) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(H£«) | B£®Ka(HF) |
| C£®c£ØF-£©/c£ØH+£© | D£®c£ØH+£©/c£ØHF£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com