
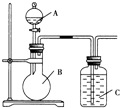
 某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:
某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:分析 (1)根据图中仪器A的特征以及常见实验仪器的名称解答,带有活塞或瓶塞的装置使用前需要检查是否漏水;
(2)氯酸钾与浓盐酸反应生成氯化钾、氯气和水,据此写出反应的化学方程式;氧化剂的氧化性大于氧化产物,A中装浓盐酸,B中装高锰酸钾溶液反应生成氯气具有氧化性,通入饱和氢硫酸溶液,反应开始后观察现象是C中产生淡黄色沉淀,说明氯气氧化硫化氢为硫单质,可证明氯的非金属性比硫的非金属性强;
(3)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝;
(4)非金属对应的最高价氧化物的水化物的酸性强,则其非金属性强,根据强酸能制弱酸的规律结合浓硝酸溶液、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3,硝酸易挥发,应除掉二氧化碳中的硝酸,再与硅酸钠反应.
解答 解:(1)图中仪器A为带有玻璃活塞特征的漏斗,为分液漏斗,分液漏斗有上口塞子和下口有控制液体流量的活塞,在使用前需要检查是否漏水,
故答案为:分液漏斗;检查是否漏水;
(2)氯酸钾在常温下与浓盐酸反应产生氯气,氯酸钾中+5价的氯元素转化成0价的氯气,HCl中-1价的氯元素转化成0价,化合价变化的最小公倍数为5,则氯酸钾的系数为1、被氧化的HCl的系数为5,再利用质量守恒定律配平可得该反应的化学方程式为:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中溶液变浑浊或有淡黄色沉淀生成,反应的化学方程式为:Cl2+H2S═S↓+2HCl;氧化剂Cl2的氧化性大于氧化产物S,可证明氯的非金属性比硫的非金属性强,
故答案为:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;溶液变浑浊或有淡黄色沉淀生成;
(3)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝,所以C中加入淀粉碘化钾溶液,反应的离子方程式为:2I-+Cl2═I2+2Cl-,
故答案为:淀粉碘化钾溶液;
(4)非金属对应的最高价氧化物的水化物的酸性强,则其非金属性强,现有浓硝酸溶液、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N>C>Si,需证明:酸性:HNO3>H2CO3>H2SiO3;因此先加入浓硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀,装置C中应装试剂为硅酸钠溶液,反应为:CO2+SiO32-+H2O=H2SiO3↓+CO32-;硝酸易挥发,硝酸进入C中与硅酸钠反应生成硅酸,不能确定C中反应物时二氧化碳还是硝酸,所以乙同学认为该装置存在不足之处是正确的,须改进,在B、C之间添加一个装有饱和碳酸氢钠溶液的洗气瓶以除去挥发逸出的硝酸,
故答案为:硅酸钠溶液;溶液变浑浊或有白色沉淀;是;在B、C之间添加一个装有饱和碳酸氢钠溶液的洗气瓶以除去挥发逸出的硝酸.
点评 本题考查比较非金属元素的非金属性强弱的实验探究,明确实验目的、正确选取实验药品、能根据实验现象得出结论是解本题的关键,试题培养了学生分析和解决问题的能力,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用作红色油漆和涂料 | B. | 碳酸氢钠可用于治疗胃酸过多 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Cl2可用于制漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
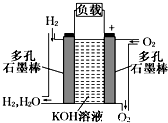 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )| A. | ①③④ | B. | ②③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚磷酸H3PO3只有Na2HPO3、NaH2PO3两种钠盐,所以亚磷酸没有正盐 | |
| B. | 同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强 | |
| C. | 配位键也有方向性和饱和性 | |
| D. | H3PO4和H2CO3分子中非羟基氧的个数均为1,他们的酸性相近,均为中强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com