
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.6��0.6 |
| 0.4��1.8 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ˮʱ����������Ϊ���������Գ�ȥˮ�е����� |
| B������ͭ���ȡ����Ƚ������������ɫ��Ӧ��������̻� |
| C���ߴ���㷺Ӧ����̫���ܵ�ء������оƬ���ά |
| D��PM2.5���е�Ǧ���ӡ������������Ԫ�ؾ�Ϊ�������к��Ľ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
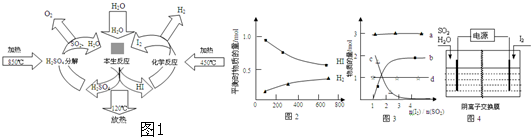
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A������ʹ���Ը��������Һ��ɫ |
| B����������ˮ�����ӳɷ�Ӧʹ��ˮ��ɫ |
| C��������������ԭ�Ӿ���ͬһƽ���� |
| D������Ũ���������¿������ᷢ��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
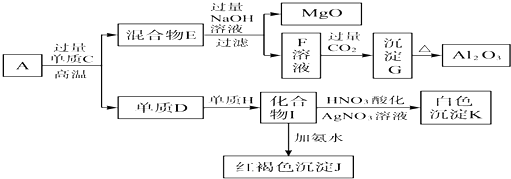
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.5Q2-0.5Q3-1.5Q1 |
| B��1.5Q1-0.5Q2+0.5Q3 |
| C��0.5Q1-1.5Q2+0.5Q3 |
| D��0.5��Q1+Q2+Q3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2x | B��4 | C��3 | D��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������=������0ʱ��״̬ |
| B��NO2ȫ��ת���N2O4��״̬ |
| C��c��NO2��=c��N2O4����״̬ |
| D��������������ٷ����仯��״̬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com