
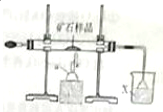
 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:分析 (1)由题目信息及问题(4)可知Cu2S、Cu2O在加热条件下得到Cu,反应还得到SO2;
(2)仪器a为酒精喷灯;二氧化硫会污染环境,需要进行吸收,防止装置内压强降低而发生倒吸;
(3)加入碱性溶液,吸收二氧化硫得到亚硫酸盐;或加热强氧化性物质,将亚硫酸氧化为硫酸;
(4)高锰酸钾溶液具有强氧化性,发生反应:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4,滴入的最后一滴高锰酸钾溶液颜色不褪去,二氧化硫反应完毕时,滴定到达终点,根据方程式计算250mL溶液中n(SO2),进而计算25mL溶液中二氧化硫的物质的量,根据硫元素守恒计算n(Cu2S),再根据m=nM计算m(Cu2S),进而计算矿石中Cu2S的质量分数;
(5)配制SO2的水溶液没有考虑空气中的O2对SO2的影响.
解答 解:(1)由题目信息及问题(4)可知Cu2S、Cu2O在加热条件下得到Cu,反应还得到SO2,反应方程式为:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑,
故答案为:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑;
(2)仪器a为酒精喷灯;二氧化硫会污染环境,需要进行吸收,使用倒置漏斗防止装置内压强降低而发生倒吸,
故答案为:酒精喷灯;防止倒吸;
(3)a.氨水与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应得到亚硫酸钡沉淀,故a符合;
b.酸性条件下,亚硫酸钡不能沉淀,故b错误;
c.加入硝酸钾溶液,酸性条件下,可以将亚硫酸氧化为硫酸,反应得到硫酸钡沉淀,故b符合;
d.硫化钠溶液,酸性条件下可以得到硫淡黄色沉淀,故d不符合,
故选:ac;
(4)高锰酸钾溶液具有强氧化性,发生反应:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4,滴入的最后一滴高锰酸钾溶液颜色不褪去,二氧化硫反应完毕时,此时无色变为紫红色,滴定到达终点;
25mL溶液中n(SO2)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×19.95×10-3L×0.1mol/L,则250mL溶液中n(SO2)=$\frac{5}{2}$n(KMnO4)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$,
由S元素守恒可知,n(Cu2S)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$,故m(Cu2S)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$×160g/mol=7.98g,
铜矿样品中Cu2S的质量分数是$\frac{7.98g}{25.00g}$×100%=31.92%,
故答案为:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4;无色变为紫红色;31.92%;
(5)配制SO2的水溶液,空气中氧气与二氧化硫发生反应:2SO2+O2+2H2O=2H2SO4,会导致测定的二氧化硫的量偏小,最终导致沉淀Cu2S的含量偏低,
故答案为:配制SO2的水溶液没有考虑空气中的O2对SO2的影响,发生反应:2SO2+O2+2H2O=2H2SO4.
点评 本题考查实验方案评价、物质含量的测定等,明确原理是解题关键,是对学生综合能力的考查,难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题

 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
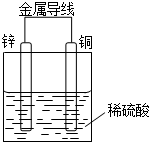 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告查看答案和解析>>
科目:高中化学 来源: 题型:选择题
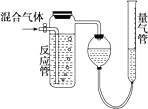 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
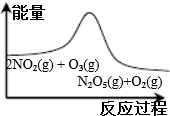 | 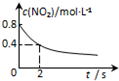 |  | 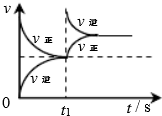 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com