
���� ��1�����¼״��������ʼ�С��˵������ƽ����Щ�ƶ���
��2������Ӧ���ʵ����������¡���ѹ������Ӧ���������Ũ�ȵȵȣ��ݴ˷�����
��3�����COת����Ӧʹƽ�������ƶ���
��� �⣺��1������ƽ����Щ�ƶ���˵������Ӧ���ȣ��ʴ�Ϊ�����ȣ�
��2��a�����״�������������Ũ�ȣ���Ӧ���ʼ�������aѡ��
b������ѹǿ����Ӧ���ʼӿ죬��b��ѡ��
c�����������������Ӧ���������Ũ�Ƚ��ͣ���Ӧ���ʼ�������cѡ��
d�����·�Ӧ���ʼӿ죬��d��ѡ��
�ʴ�Ϊ��ac��
��3���÷�ӦΪ����Ӧ���������С�ķ��ȷ�Ӧ����ѹ����������Ũ���ܼӿ췴Ӧ���ʣ�����ʹһ����̼��ת������ߣ��ʴ�Ϊ������ѹǿ������������Ũ�ȣ�
���� ���⿼����Ӱ��ƽ���ƶ��ͻ�ѧ��Ӧ���ʵ����أ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | CH3Br | B�� | CH3CH2CH2CH2Br | ||
| C�� | CH2BrCH2Br | D�� | CH2BrCH2CH2CH2Br |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ��A��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ0.6 mol•L-1•min-1 | |
| B�� | �÷�Ӧ��B��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ2.4 mol•L-1•min-1 | |
| C�� | 2v��B��=3v��C�� | |
| D�� | ��������C��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ3.6 mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S | B�� | NH3 | C�� | Fe | D�� | Na |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol/LNaHCO3��Һ�У�c��Na+����c��HCO3-����C��CO32-����c��H2CO3�� | |
| B�� | ��0.1mol/LNa2CO3��Һ�У�c��OH-��-c��H+��=c��HC03-��+c��H2CO3�� | |
| C�� | ��0.2mol/LNaHCO3��Һ�м�������0.1mol/LNaOH��Һ��c��CO32-����c��HCO3-����c��OH-����c��H+�� | |
| D�� | �����£�CH3COONa��CH3COOH�����Һ[pH=7��c��Na+��=0.1mol/L]��c��Na+��=c��CH3COO-����c��CH3COOH����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| MnO2 | �����Թ���� | �۲��� | ��Ӧ��������ʱ�� |
| ��ĩ״ | ���� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5min |
| ��״ | �� | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30min |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪AΪ�������ʣ��������б仯����������⣺
��֪AΪ�������ʣ��������б仯����������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
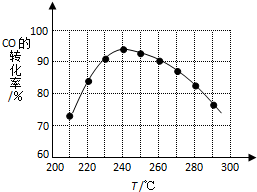 �����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3���¹�����Ҫ����������Ӧ��
�����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3���¹�����Ҫ����������Ӧ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com