
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
【答案】第二周期第ⅤA族 氯 ![]()
 Si
Si ![]() ①③ Si (s)+ 2Cl2(g)== SiCl4(l) △H = -687 kJ/mol NO 0.9mol NO2 1.3mol 2mol
①③ Si (s)+ 2Cl2(g)== SiCl4(l) △H = -687 kJ/mol NO 0.9mol NO2 1.3mol 2mol
【解析】
W、X、Y、Z、M、E、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与E的最低负化合价相同,则Z和E位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为Si元素,故Z为O元素,E为S元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素,据此分析。
W、X、Y、Z、M、E、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与E的最低负化合价相同,则Z和E位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为Si元素,故Z为O元素,E为S元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素。
(1)Y为N元素,在周期表中的位置为第二周期第ⅤA族,Q的元素名称为氯;
(2)X为C元素,其最高价氧化物CO2的电子式为![]() ;Y和W形成的五核离子NH4+的电子式为
;Y和W形成的五核离子NH4+的电子式为 ;
;
(3)元素周期表中同周期从左到右原子半径依次减小,同主族从上而下依次增大,表中元素原子半径最大的是Si;
(4)X与E的最高价氧化物的水化物H2SO4反应的化学反应式为![]() ;
;
(5) ① Y单质与H2S溶液反应,说明氧气的氧化性比硫强,从而说明O元素的非金属性比S元素的非金属性强,故正确;
②氧化性的强弱与得电子的多少无关,故错误;
③元素的非金属越强,简单气态氢化物的稳定性越强,故正确;
答案选①③;
(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,两种气体为NO、NO2,最终转化为NaNO3,1mol O2参与反应转移电子的物质的量为4mol,设NO、NO2的物质的量分别为xmol、ymol,根据Na、N守恒得x+y=2.2①,根据电子守恒得3x+y=4②,联立方程解得:x=0.9,y=1.3,根据电子守恒:n(CuSO4)=![]() =2mol,故答案为NO 0.9mol、NO2 1.3mol;2mol。
=2mol,故答案为NO 0.9mol、NO2 1.3mol;2mol。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】无水三氯化铬![]() 在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用
在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用![]() 和
和![]() 在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
实验原理: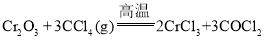
已知:①![]() 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
②![]() 沸点为57.6℃;
沸点为57.6℃;
③在碱性条件下,![]() 能把
能把![]() 氧化为
氧化为![]() ;
;
在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 。
。
回答下列问题:
Ⅰ.氮气的制备
(1)利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
)制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
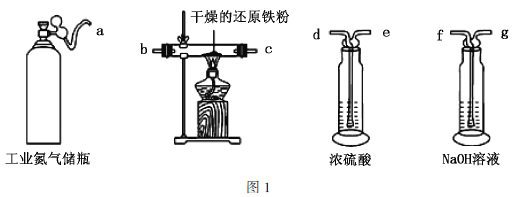
Ⅱ.无水三氯化铬的制备
实验装置如图2所示(加热、夹持等装置已略去)。
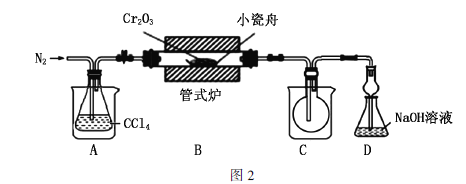
(2)通入![]() 的作用是_____________(写出2点)。
的作用是_____________(写出2点)。
(3)装置A和装置C的烧杯中分别盛放________、________。
(4)制备![]() 时生成的气体
时生成的气体![]() (俗称光气)有毒,
(俗称光气)有毒,![]() 遇水发生水解,反应方程式为
遇水发生水解,反应方程式为![]() 。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
(5)图2装置中有设计不合理的地方,你认为应该改进的措施有______________。
Ⅲ.产品中![]() 质量分数的测定
质量分数的测定
a.称取![]()
![]() 产品,在强碱性条件下,加入过量的30%
产品,在强碱性条件下,加入过量的30%![]() 溶液,小火加热使
溶液,小火加热使![]() 完全转化为
完全转化为![]() ,继续加热一段时间;
,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓![]() 和浓
和浓![]() ,使
,使![]() 转化为
转化为![]() ;
;
c.用新配制的![]() 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:
硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:![]() ),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
(6)①上述操作a中“继续加热一段时间”的目的是________。
②加浓![]() 的目的是为了防止指示剂提前变色。若不加浓
的目的是为了防止指示剂提前变色。若不加浓![]() ,则测得的
,则测得的![]() 的质量分数将________(填“偏低”、“偏高”或“不变”)。
的质量分数将________(填“偏低”、“偏高”或“不变”)。
③产品中![]() 的质量分数为________%(保留一位小数)。
的质量分数为________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气相条件下,立方烷能自发地发生热重排反应生成一系列化合物。下列说法正确的是
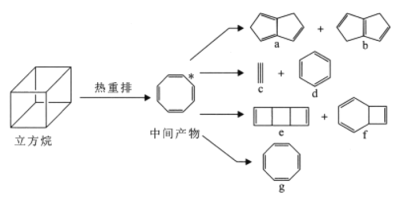
A.a、f中所有原子均可处于同一平面
B.1mol化合物e完全燃烧消耗12molO2
C.六硝基立方烷最多有3种结构(不考虑立体异构)
D.立方烷热重排产物均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2 +3H2![]() 2NH3 △H<0,达到平衡后,当单独改变下述条件时,有关叙述错误的是
2NH3 △H<0,达到平衡后,当单独改变下述条件时,有关叙述错误的是
A.加催化剂,υ正、υ逆都发生变化,且变化的倍数相等
B.加压,υ正、υ逆都增大,且υ正增大的倍数大于υ逆增大的倍数
C.降温,υ正、υ逆都减小,且υ正减小的倍数小于υ逆减小的倍数
D.增大氮气的浓度,υ正、υ逆都增大,且υ正增大倍数大于υ逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 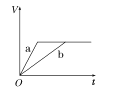 B.
B. 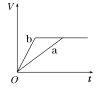 C.
C. 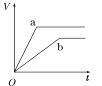 D.
D. 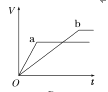
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
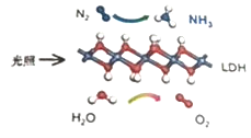
A.该过程将太阳能转化成为化学能
B.该过程中,只涉及到极性键的断裂与生成
C.氧化剂与还原剂的物质的量之比为1:3
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在探究淡黄色过氧化钠与水反应是放出热量还是吸收热量时设计了如图所示的实验装置。

在小试管里加入1g淡黄色过氧化钠,把小试管套在带支管的试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,可观察到U形管右侧的液面立即下降,左侧的液面上升。
(1)过氧化钠的电子式__。
(2)写出上述反应的化学方程式__。
(3)下列各图中,表示过氧化钠与水反应的图是(_______)
A.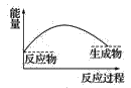 B.
B.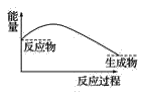
C.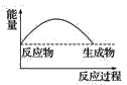 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:
(1)瑞德西韦是一种抗病毒药物,结构如下。

该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。
(2)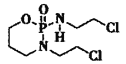 (异环磷酰胺)常用作抗癌药,1mol该物质含
(异环磷酰胺)常用作抗癌药,1mol该物质含![]() 键数目为______NA。
键数目为______NA。
(3)实验测得![]() 中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
(4)![]() 可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,
可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,![]() 的空间构型为____________。
的空间构型为____________。
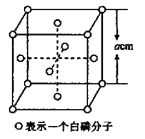
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为![]() ,晶体中白磷分子之间的最短距离为____________cm(用含
,晶体中白磷分子之间的最短距离为____________cm(用含![]() 、NA的式子表示)。
、NA的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com