

分析 (1)根据碳原子的电子层数、最外层电子数确定碳元素在周期表中的位置;非金属性越强,气态氢化物越稳定;计算1mol甲烷完全燃烧生成液态水时放热量,热化学方程式中化学计量数代表物质的量;
(2)C60由分子构成,金刚石为原子构成的原子晶体,只含共价键;由图可知,等物质的量时,金刚石的能量比石墨的高;
(3)容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol•L-1.s-1,可知生成氢气为0.3mol•L-1.s-1×4s=1.2mol/L,由反应可知转化的甲烷为1.2mol/L×$\frac{1}{3}$=0.4mol/L,焓变为正;电解时电能转化为化学能,以此来解答.
解答 解:(1)C是两个电子层,最外层4个电子,所以在元素周期表中的位置为第二周期ⅣA族;
非金属性越强,气态氢化物越稳定,非金属性O>C,所以气态氢化物的稳定性CH4<H2O;
1g甲烷完全燃烧生成液态水时放热55.6kJ•mol-1,由物质的量与热量成正比、焓变为负,可知热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1,
故答案为:第二周期ⅣA族;甲烷(或CH4);CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1;
(2)C60由分子构成,C60所属的晶体类型为分子晶体;金刚石熔化时破坏的作用力是共价键;由金刚石、石墨的能量关系图可知,等物质的量时,金刚石的能量比石墨的高,则等质量的金刚石和石墨完全燃烧,产物相同,金刚石放出热量更多,石墨转化为金刚石的热化学方程式为C(s,石墨)=C(s,金刚石)△H=(-110.5kJ/mol-283kJ/mol)-(-395.4kJ/mol)=+1.9 kJ•mol-1,
故答案为:分子晶体;共价键;金刚石; C(s,石墨)=C(s,金刚石)△H=+1.9 kJ•mol-1;
(3)容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol•L-1.s-1,可知生成氢气为0.3mol•L-1.s-1×4s=1.2mol/L,由反应可知转化的甲烷为1.2mol/L×$\frac{1}{3}$=0.4mol/L,4s时剩余的甲烷的浓度为1mol/L-0.4mol/L=0.6mol/L;焓变为正,该反应发生时吸收能量;电解时电能转化为化学能,
故答案为:0.6mol•L-1,吸收; 电能转化为化学能.
点评 本题考查化学平衡计算及反应热计算,为高频考点,把握图中能量变化、反应中能量变化、化学平衡计算为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:填空题
将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为_______________。
(2)该溶液中NaOH的质量分数为__________
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为__________,NaOH的质量分数为__________,溶液的密度为___________,含NaOH的质量为_________,含NaOH的物质的量为__________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
关于铅蓄电池Pb+PbO2+2H2SO4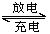 PbSO4+2H2O的说法正确的是
PbSO4+2H2O的说法正确的是
A.在放电时,正极发生的反应是Pb(s)+SO42—(aq)=PbSO4(s)+2e—
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e—=Pb(s)+SO42—(aq)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用VA、VB、VC表示,已知2VB=3VA、3 VC =2 VB,则此反应可表示为( )
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
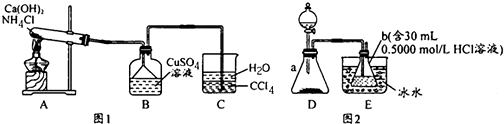
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
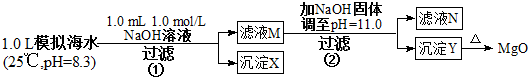
| 海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3,MgCO3 | |
| B. | 滤液M中存在Mg2+,不存在Ca2+ | |
| C. | 滤液N中存在Mg2+、Ca2+ | |
| D. | 步骤②中若改为加入8 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
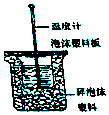 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com