
分析 (1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,根据元素守恒配平其它物质的系数.
(2)反应中化合价升高的元素所在的反应物是还原剂.
解答 解:(1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,根据Au守恒可知Au2O系数为1,根据硫元素守恒可知Na2S2O3系数为4,根据元素Na元素守恒可知NaOH的系数为4,根据H元素守恒可知H2O系数为2,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH.
故答案为:4Na2S2O3、2H2O;Au2O、2Na2S4O6、4NaOH.
(2)Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价升高的元素所在的反应物是还原剂,故答案为:Na2S2O3.
点评 本题考查氧化还原反应的配平、基本概念等,难度中等,根据化合价、元素守恒判断反应物、生成物是解题的关键,掌握化合价升降法配平氧化还原反应方程式即可.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | O2通入正极区 | |
| B. | 总反应为:2H2+O2═2H2O | |
| C. | 正极发生氧化反应 | |
| D. | 负极区电极反应为 2H2+4OH--4e-═4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW | B. | 可逆反应的平衡常数K | ||
| C. | 0.1mol/LCH3COONa溶液的pH | D. | NH3•H2O的电离常数Kb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
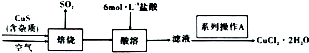
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
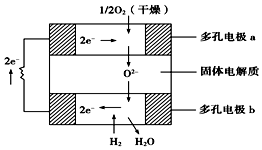 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | b极的电极反应式为H2+O2--2e-═H2O | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 氧化锆的作用是让电子在电池内部通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
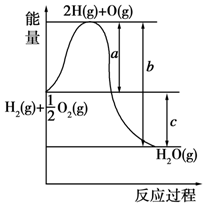 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式为: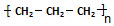 | B. | 四氯化碳分子的电子式: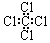 | ||
| C. | 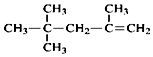 的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 | D. | 乙醇分子比例模型: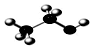 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L H2中含有的H原子数是NA | |
| B. | 标准状况下,11.2L CCl4含有0.5NA个分子 | |
| C. | 0.1 mol C含质子数为1.2NA | |
| D. | 2.3g金属钠含有的电子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有NA个水分子 | |
| B. | 常温常压下,28gCO中所含的原子数目为2NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1L 1mo1/L的NaHSO4溶液中,HSO4-离子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com