
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1H2SO3溶液过程中的pH变化如图所示。下列说法错误的是
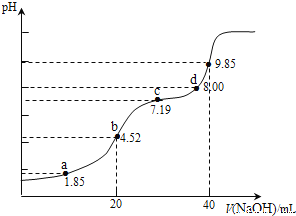
A. a点所得溶液中:3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c点所得溶液中:c(SO32-)=c(HSO3)
D. d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
【答案】A
【解析】A. a点所得溶液中:用0.1000molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,pH=1.85= pKa1,由电离平衡常数表达式可知c(H2SO3)=c(HSO3-),HSO3-既能电离又能水解,但是以电离为主,其电程度小于H2SO3,所以此时所加NaOH溶液的体积小于10mL,溶液总体积小于30ml,由物料守恒可知,a点所得溶液中c(H2SO3)+c(HSO3-)+c(SO32-)>(20mL×0.1molL-1)/30mL=![]() 0.2000molL-1,所以3c(H2SO3)+3c(HSO3-)+3c(SO32-)>0.2000molL-1,A不正确;B. b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,由溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-)及物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),可以得到c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;C. c点所得溶液中的溶质为Na2SO3和NaHSO3,由pH=7.19= pKa2,由电离平衡常数表达式可知c(SO32-)=c(HSO3),C正确;D. d点所得溶液中,加入氢氧化钠溶液的体积为40ml,恰好与20mL0.1molL-1H2SO3溶液反应生成Na2SO3,有少量的SO32-发生水解生成HSO3-,所以溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),D正确。本题选A。
0.2000molL-1,所以3c(H2SO3)+3c(HSO3-)+3c(SO32-)>0.2000molL-1,A不正确;B. b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,由溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-)及物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),可以得到c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;C. c点所得溶液中的溶质为Na2SO3和NaHSO3,由pH=7.19= pKa2,由电离平衡常数表达式可知c(SO32-)=c(HSO3),C正确;D. d点所得溶液中,加入氢氧化钠溶液的体积为40ml,恰好与20mL0.1molL-1H2SO3溶液反应生成Na2SO3,有少量的SO32-发生水解生成HSO3-,所以溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),D正确。本题选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
![]()
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是____________,碱性最强的是______。(填化学式)
(3)气体分子(MN)2的电子式为___________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下图烧杯中各盛有40 mL的溶液。

(1)甲溶液pH=__________,水电离的c(OH-)=________mol/L。
(2)若分别取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水电离的c(H+)=________mol/L;溶液中离子浓度大小顺序是__________。
(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,该溶液中离子浓度大小顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是解热镇痛抗炎药,其结构如图所示。下列有关说法正确的是

A. 分子式为C17H14O5N
B. 贝诺酯能发生银镜反应
C. 1 mol贝诺酯与H2发生加成反应最多消耗8mol H2
D. 在氢氧化钠水溶液中水解可以得到3种有机物钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用回答下列问题:
(1)As原子的核外电子排布式为_________________;P的第一电离能比S大的原因为_______________
(2)写出一种与CNˉ互为等电子体的粒子________(用化学式表示);(SCN)2分子中σ键和π键个数比为___________
(3)砒霜剧毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的杂化方式为__________,AsO43-的空间构型为___________
(4)NH4+中H一N一H的键角比NH3中H 一N一H的键角大的原因是__________;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图I),该化合物加热时首先失去水,请从原子结构角度加以分析:__________
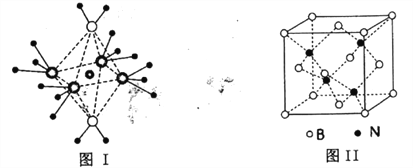
(5)BN的熔点为3000℃,密度为2.25g·cm-3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有__________个;若原子半径分别为rNpm和rBpm,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
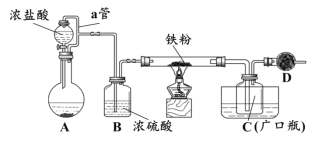
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2==2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为______________________________。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+3C(s)==Al2OC(s)+2CO(g)△H1
2Al2OC(s)+3C(s)==Al4C3(s)+2CO(g)△H2
2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)△H3
①△H3=_________(用△H1、△H2表示)。
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为__________________________。(3)下列是碳热还原制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压×气体的物质的量分数)。

I.Mn3C(s)+4CO2(g) ![]() 3MnO(s)+5CO(g)Kp(I)
3MnO(s)+5CO(g)Kp(I)
II.Mn(s)+CO2(g) ![]() MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s)+CO2(g) ![]() 3Mn(s)+2CO(g)Kp(III)
3Mn(s)+2CO(g)Kp(III)
①△H>0的反应是__________________(填“I”“II”或“I”)。
②1200K时,在一体积为2L的恒容密闭容器中有17.7gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5min内V(CO2)=____________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是____________(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为akPa时,CO2的转化率为______________;A点对应温度下的Kp(III)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
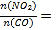
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
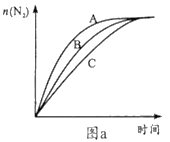
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
A. 上述反应平衡常数的表达式为:K=[c(H+)·c2(CrO42-)]/[c(Cr2O72-)·c(H2O)]
B. 实验①现象:溶液由橙色变为黄色,实验②现象:溶液由黄色变为橙色
C. 实验①和②的目的是探究H+浓度对上述平衡的影响
D. 预测稀释K2Cr2O7溶液时,溶液颜色由橙色变为黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com