
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
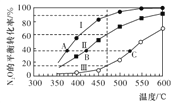
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
【答案】D
【解析】A项,由图可得,温度升高N2O的平衡转化率增大,所以温度升高促进化学平衡正向移动,该反应的正反应吸热,故A错误;B项,容器Ⅰ和Ⅱ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率Ⅰ大于Ⅱ,因此压强Ⅰ小于Ⅱ,所以相同温度下反应相同时间,平均反应速率:v(Ⅰ)<v(Ⅱ),故B错误;由图可得,容器Ⅱ在470℃进行反应时N2O的平衡转化率为60%,则平衡时c(N2O)=0.04mol/L、c(N2)=0.06mol/L、c(O2)=0.03mol/L,所以K=![]() =
=![]() =0.0675,由表中数据可得,容器Ⅳ在470℃进行反应时,Q=
=0.0675,由表中数据可得,容器Ⅳ在470℃进行反应时,Q=![]() =0.04,所以Q<K,平衡正向移动,v正(N2O)>v逆(N2O),故C错误;D项,容器Ⅰ、Ⅱ、Ⅲ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率:Ⅰ>Ⅱ>Ⅲ,因此反应开始时压强:Ⅰ<Ⅱ<Ⅲ,则转化率均为40%时的A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ),故D正确。
=0.04,所以Q<K,平衡正向移动,v正(N2O)>v逆(N2O),故C错误;D项,容器Ⅰ、Ⅱ、Ⅲ中N2O的起始物质的量相等,因为该反应正向气体分子数增大,所以压强越小N2O的平衡转化率越大,由图可得,相同温度下N2O的平衡转化率:Ⅰ>Ⅱ>Ⅲ,因此反应开始时压强:Ⅰ<Ⅱ<Ⅲ,则转化率均为40%时的A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ),故D正确。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
A. 在饱和AgCl、AgBr的混合溶液中:![]() =360
=360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象_____。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式_____。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O。

①装置A中的试剂是_____。
②干燥管和装置B的作用分别是_____、_____。
③实验开始时正确的操作步骤是_____。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂的物质的量之比为1:2的是
①2CH3COOH+Ca(C1O)2=2HC1O+Ca(CH3COO)2
② SiO2+2C![]() Si+2CO↑
Si+2CO↑
③4HC1(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
④SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
A. 仅有② B. 仅有②④ C. 仅有②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
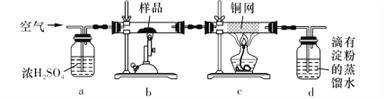
现用电子天平称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20. 00 mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是_____________________;标准碘溶液应盛放在___________(填“碱式”或“酸式”)滴定管中。
(2) a装置的作用是__________________(填字母代号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果_______________(填“偏低”“偏高”或“无影响”),写出影响测定结果的化学方程式:________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是___________________________。
(5)通过计算可知,该黄铜矿的纯度为_________________________。
(6) 假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. Fe和盐酸反应:Fe+2H+ ═Fe3++H2↑
C. NO2溶于水的反应:3NO2+H2O ═ 2H+ + 2NO3- + NO
D. 氧化铜与硫酸反应:CuO+2H+═ Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸铜加热分解生成CuO、O2、SO2和SO3(g)。通过测定产生的三种气体的量可确定该反应的方程式。实验用到的仪器如下图所示。

有关操作和结果如下(已知:H++HSO3-=SO2↑+H2O)。
①准确称取一定质量的无水CuSO4固体充分加热到完全分解。
②实验后测得装置F总质量比实验前减少了0.96 g(忽略水蒸气的损失和SO2的溶解)。
③干燥管C在实验后质量增加3.84 g。
④由量筒中水的体积,折算出标准状况下相应气体的体积为224 mL。
试回答下列问题:
(1)装置C的作用是__________________,装置F的作用是______________。
(2)使用上图所给仪器装置(可重复使用),按从左到右的方向连接各仪器,接口顺序为①→⑨⑩→⑥⑤→________→________→________→②(填序号) 。
(3)装置F中发生反应的化学方程式为_______________________________________。
(4)请通过计算,推断出该条件下反应的化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com