
| A、标况下,4.48L SO2中含O原子数为0.4NA |
| B、常温常压下,8.96LCO2中所含分子数为0.4 NA |
| C、500mL 0.1 mol/L的NaOH溶液中含OH-的数目为0.05NA |
| D、常温常压下,1.6g CH4中含H原子数为0.4NA |
| m |
| M |
| m |
| M |
| 1.6g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、镀锌的铁比镀锡的铁耐用 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、铝片不用特殊方法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3=Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: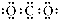 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤ | B、②④⑤ |
| C、①③⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO2发生氧化反应 |
| B、每生成1molN2时转移电子的物质的量为6mol |
| C、N2既是氧化产物,又是还原产物 |
| D、NH4Cl中的氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成原子个数比为1:1的化合物只有两种 |
| B、Y、W的氧化物均为酸性氧化物 |
| C、最高价氧化物对应水化物的酸性Y<W |
| D、X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
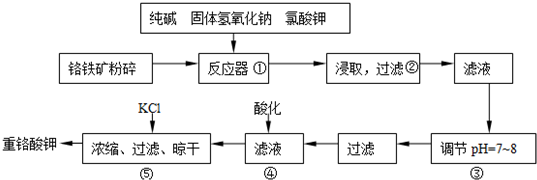
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com