
【题目】下表中物质分类组合完全正确的是( )
A | B | C | D | |
酸 | HCl | H2SO4 | NaHSO4 | HNO3 |
碱 | Na2CO3 | NaOH | Fe(OH)3 | KOH |
盐 | CuSO4 | BaSO4 | NaCl | NaHCO3 |
氧化物 | H2O | KClO3 | CuO | Na2O |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
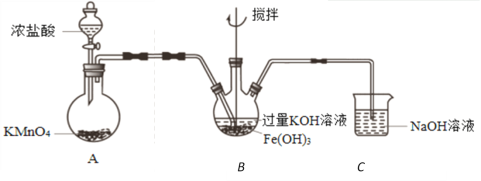
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 mL 10%的硫酸铜溶液中滴加4~5滴2%的氢氧化钠溶液,再加入2 mL 10%的葡萄糖溶液,加热,未观察到红色沉淀,最主要的原因是( )
A.加热温度太高
B.葡萄糖溶液中含有少量的果糖
C.生成了氧化亚铜
D.氢氧化钠不足
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,E的元素符号为___________
(2)A、B两种元素可形成化学式为B2A、B2A2等化合物,则B2A2的电子式为_____。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________
(4)DA2与E元素的单质在水中反应的离子方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是

A. A的水溶液显碱性
B. D为一种红棕色气体
C. B和F能发生复分解反应生成盐
D. F在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
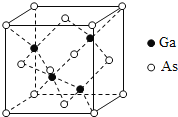
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为___________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_______________。
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正硫的是
A. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
B. 用铜做阳极电解氯化铜溶液:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
C. 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
D. 泡沫灭火器工作时化学反应:2Al3++3CO32-+6H2O=Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: _______________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量________(填“大于”、“小于”或“等于”)形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com