
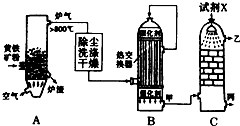
 合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:
合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:分析 (1)工业上利用黄铁矿在沸腾炉内燃烧生成SO2,再将SO2在接触室内催化氧化生成SO3,此过程因放热,通过热交换器转移能量给反应物预热,同时给反应降温,促进反应正向移动,提高SO2的转化率,在吸收塔利用浓硫酸吸收SO3可提高吸收效率;
①设备A中煅烧黄铁矿,设备名称是沸腾炉;
②因SO3溶解于水放热形成酸雾,吸收效率低,改用浓硫酸吸收;
③B设备中热交换器是将反应中放出的热量转移出来给反应物预热,同时促进平衡正向移动;
(2)工业制硝酸,酸吸收塔中的水吸收NO2是放热反应,可通过降温和增大压强,促进NO2的溶解,产生的尾气NO2用碳酸钠吸收,可结合3NO2+H2O=2HNO3+NO及NO+NO2+H2O=2HNO2考虑,写出此反应的化学方程式;
(3)合成氨是利用氮气和氢气高温催化生成的,此反应是可逆反应,工业上常选择天然气作为合成氨原料气,是因为天然气资源丰富,成本低的原因.
解答 解:(1)①沸腾炉中煅烧黄铁矿,设备A是沸腾炉,故答案为:沸腾炉;
②吸收塔内利用98.3%的浓硫酸吸收SO3形成发烟硫酸,可提高SO3的吸收效率,故答案为:98.3%的硫酸;
③设备B中利用热交换器可转移能量给反应物预热,充分利用能量,同时促进平衡正向移动,提高SO2的转化率,故答案为:充分利用能量、提高SO2的转化率;
(2)因NO2溶解于水放热,为促进气体的溶解,可采取降温和增大压强的方式,用Na2CO3吸收NO2的尾气发生反应的化学方程式为2NO2+Na2CO3═NaNO2+NaNO3+CO2,故答案为:降温、加压;2NO2+Na2CO3═NaNO2+NaNO3+CO2;
(3)合成氨发生反应的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3,因天然气成本低、能源低工业上通常用天然气作为合成氨的原料气,故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3;原料价格低、能耗低.
点评 本题是工业制硫酸、硝酸及合成氨流程中部分操作原理的分析,属基础性考查,难度较低,理解掌握这三个工业制备原理是解题关键,这就要求学生要重视基础知识的学习,培养自己分析问题解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A配置0.10mol/LNaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | 配制0.10mol/L NaOH溶液 | |
| B. | 除去CO中的CO2 | |
| C. | 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 记录滴定终点读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl3与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟硝酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始物质的量/mol | 0.1 | 0.3 | 0 |
| 平衡物质的量/mol | 0.05 | 0.2 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+2Y?2Z | |
| C. | 若起始时X、Y、Z的物质的量分别为0.1 mol、0.4mol、0.2mol,达平衡时,Z的体积分数一定增大 | |
| D. | 若起始时X、Y、Z的物质的量分别为0.05 mol、0.15mol、0.1mol,达平衡时,X的转化率一定与原投料相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH(OH)CH2OU和CH3CH(Cl)CH2CH3都是手性分子 | |
| B. | NH4+与H3O+的空间构型相似 | |
| C. | BF3与苯都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com