
【题目】光气是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气很容易水解,熔点为-118°C,沸点为8.2°C。某科研小组模拟工业生产由一氧化碳和氯气的混合物在活性炭作催化剂的条件下制取光气,其反应原理为:Cl2+CO=COCl2。装置如图所示(丙处的加油装置已省略,D中仪器用于收集光气)。
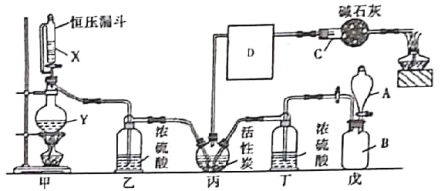
(1)仪器C的名称为___,其中碱石灰的作用为________________,D中仪器应浸在_____(填“冰水浴”或“热水浴”)中。
(2)仪器组装完成后,检验甲装置气密性的方法是_________。
(3)戊装置主要用于制取氯气,用酸性KMnO4和盐酸制取氯气时的离子方程式为__________。
(4)光气极易水解,遇水后易产生一种氢化物和一种氧化物,其反应的化学方程式为______。
【答案】球形干燥管 吸收Cl2和HCl,防止大气污染 冰水浴 塞好恒压漏斗上面的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热烧瓶,若导管口有气泡生成,停止加热时,导管口有一端稳定的液柱,则表明气密性良好 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O COCl2+H2O=CO2+2HCl
【解析】
(1)根据装置图判断仪器名称及装置的作用;
(2)利用微热法减压装置的气密性;
(3)酸性KMnO4和盐酸在常温下可制取氯气,并且不用担心盐酸浓度降低反应停止的问题;
(4)光气极易水解,与水生成HCl和CO2。
(1)根据装置图可知仪器C为球形干燥管;碱石灰可吸收反应产生的Cl2和HCl,防止大气污染;装置D应浸在冰水浴中,防止空气中水蒸气进入D中使光气水解;
(2)塞好恒压漏斗上面的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热烧瓶,若导管口有气泡生成,停止加热时,导管口有一端稳定的液柱,则表明气密性良好;
(3)酸性KMnO4和盐酸在常温下可制取氯气,反应方程式为:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)光气极易水解,与水生成HCl和CO2,反应方程式为COCl2+H2O=CO2+2HCl
方法 | 微热法 | 液差法 | 气压法 |
原理 | 升高装置中气体的温度,使气体体积膨胀 | 缩小装置中气体的体积,增大压强 | 封闭气体压强增大,使液滴不能滴下 |
图示 |
|
|
|
具体 操作 | 塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶 | 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水 | 塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水 |
现象 说明 | 烧杯中有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降 | 停止加水后,长颈漏斗中的液面高于试管中的液面,且一段时间内液面差不变 | 一段时间后,液滴不能滴下 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
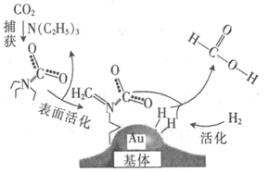
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是
A.![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH===CH2+ NaOH![]() HOCH2CH===CH2+NaCl
HOCH2CH===CH2+NaCl
D.![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.过氧化钠与水反应时,生成0.1 mol氧气转移的电子效为0.2NA
B.标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C.将100mL 0.1 mol·L-1 FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01 NA
D.浓硫酸(含1 mol H2SO4)与足量Cu加热发生反应生成0.5 NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年为“国际化学元素周期表年”(IYPT2019)。元素周期表隐含着许多的信息和规律,以下所涉及的元素均为中学化学常见短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法不正确的是

A.元素周期表有7个周期,16个族,共有118种元素,其大多数是金属元素
B.x和e组成的化合物属于离子化合物,该化合物具有较强的还原性
C.d、f、g、h的离子半径顺序g>h>d>f
D.y、z、h的最简氢化物的沸点h>z>y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素同周期,X的金属性在同周期元素中最强;Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位;W的最高价氧化物的水化物的化学式为HnWO2n+2。下列说法正确的是( )
A.简单离子半径:X<Y<W
B.Y、Z两种元素的氧化物均具有两性
C.X、W分别形成的氢化物中所含化学键种类相同
D.Z、W形成化合物的电子式为: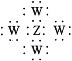
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以水钴矿(主要成分为Co2O3,还含Fe、A1、Mg、Ca、Si等元素)制备钴的氧化物,工艺如图所示。回答下列问题:

相关金属离子[co(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:

(1)水钴矿中的Fe、A1、Mg、Ca元素的存在形态为___(填“游离态”或“化合态”)。
(2)“酸溶”中Co2O3反应的离子方程式是___,滤渣1的成分可能是___。
(3)“氧化”中加Co2O3的作用是___。
(4)“调pH”为4.7-6之间,则滤渣2为___。
(5)已知Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,“除杂”是为了除去Ca2+和Mg2+,此时先析出的沉淀是___(填化学式),过程中![]() 最大值为___(列出算式即可)。
最大值为___(列出算式即可)。
(6)实验室拟在空气中煅烧CoC2O4以探究其产物。实验时将13.23gCoC2O4放入___(填仪器名称)中,测得生成钴的某种氧化物7.23g和气体CO2。据此预测:该氧化物中Co化合价的可能情况是___,真实情况有待进一步查证。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fex(OH)y(SO4)z](铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL的溶液。②准确量取25.00 mL溶液,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体6.99g。③准确量取25.00mL溶液,加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥、灼烧至恒重,得到红棕色固体1.92g。该聚合硫酸铁组成中x∶y∶z的值为
A. 6∶8∶5 B. 4∶2∶5 C. 1∶1∶2 D. 6∶3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com