
����Ŀ��(1)���÷�ӦCu��2FeCl3=CuCl2��2FeCl2��Ƴ���ͼ��ʾԭ��أ��ش��������⣺

��д���缫��Ӧʽ������__________________________ ��
��ͼ��X��Һ��_______________��
��ԭ��ع���ʱ�������е�________(����������������)������X��Һ�����ƶ���
(2)��ͼ��һ����ѧ���̵�ʾ��ͼ��

�ټ׳���OH-����__________��������CH3OH������O2������
��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ_______________��
���ҳ����ܷ�Ӧ�����ӷ���ʽ___________________��
�ܵ��ҳ���B��A g��������������5.40g������ʱ�ҳ�����Һ�����Ϊ500ml������Һ��C(H+)��___________����ʱ����ij�缫����1.60gij����������е�ij����Һ������______________������ţ���A��MgSO4 B��CuSO4 C��NaCl D��AgNO3
���𰸡�Fe3����e-=Fe2�� FeCl3 �� CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O![]() 4Ag+O2��+4H+ 0.1mol��L��1 BD
4Ag+O2��+4H+ 0.1mol��L��1 BD
��������
(1) ����ӦCu��2FeCl3=CuCl2��2FeCl2����ͭʧ���ӷ���������Ӧ��Fe3+�õ��ӷ�����ԭ��Ӧ��ԭ���������������ԭ��Ӧ��̼�������������Ļ�ԭ��ӦΪ��Fe3����e-=Fe2�����������������������Fe3����e-=Fe2����
��ʯī����������������ӦΪ��Fe3����e-=Fe2��������ͼ��X��Һ��FeCl3 ��Һ���������������������FeCl3 ��
��ԭ��ع���ʱ������������������ʯī�����������������е���������X��Һ�����ƶ��������������������������
(2) ��ȼ�ϵ����,Ͷ��ȼ�ϵĵ缫�Ǹ���,Ͷ���������ĵ缫������,ԭ��طŵ�ʱ,�������Һ���������������ƶ�,����Ͷ�ż״��ĵ缫�ƶ����������������������CH3OH��
����ȼ�ϵ����,�״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ,�缫��ӦʽΪ: CH3OH-6e-+8OH-=CO32-+6H2O����ˣ�������ȷ������CH3OH-6e-+8OH-=CO32-+6H2O��
�������������Һʱ,�����ӵõ�����������ˮʧ��������������������,���ӷ���ʽΪ4Ag++2H2O![]() 4Ag+O2��+4H+ ���������������������4Ag++2H2O
4Ag+O2��+4H+ ���������������������4Ag++2H2O![]() 4Ag+O2��+4H+��
4Ag+O2��+4H+��
�����ҳ���B��Ag��������������5.40g ʱ����������Ũ��Ϊxmol/L��4Ag++2H2O![]() 4Ag+O2��+4H+�����ݷ�Ӧ��ϵ��4Ag---4H+��432��4=5.4��0.5x������ó�: x=0.1��������Һ��c(H+)=0.1mol��L��1���������������������ڽ������˳����н���Ԫ�ش���HԪ�غ������ݴ��������ת�Ƶ��������֪��������������Ԫ����Ҫ�ĵ��ӵ��ڻ�С���ҳ���ת�Ƶ��������ݴ�ȷ�����еĽ���Ԫ��,����5.40g ʱת�Ƶ�����0.05mol����ʱ����ij�缫����1.60gij����������е�ij����Һ��������
4Ag+O2��+4H+�����ݷ�Ӧ��ϵ��4Ag---4H+��432��4=5.4��0.5x������ó�: x=0.1��������Һ��c(H+)=0.1mol��L��1���������������������ڽ������˳����н���Ԫ�ش���HԪ�غ������ݴ��������ת�Ƶ��������֪��������������Ԫ����Ҫ�ĵ��ӵ��ڻ�С���ҳ���ת�Ƶ��������ݴ�ȷ�����еĽ���Ԫ��,����5.40g ʱת�Ƶ�����0.05mol����ʱ����ij�缫����1.60gij����������е�ij����Һ��������
A������þ��þԪ�ش���HԪ��ǰ,���������ϲ����������������ʴ�����
B���������ͭ��Һʱ,����������1.6gͭ��Ҫת�Ƶ���0.05mol,����ȷ��
C��NaCl����Ԫ�ش�����Ԫ��ǰ�����������ϲ����������������ʴ�����
D�������������Һʱ,����������1.6g ����Ҫת�Ƶ���0.0148mol<0.05mol,����ȷ��
��ˣ�����ѡ:BD��
�������������������0.1mol��L��1��BD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ����
A. �ں�CO32-����ΪNA��Na2CO3��Һ�У�Na+����Ϊ2NA
B. ��״���£�2.24 L����ͱ�ϩ�Ļ�����к���ԭ����ĿΪ0.6NA
C. ��0.1 mol H2��0.2 mol I2(g)�����ܱ������г�ַ�Ӧ�����ɵ�H-I����ĿΪ0.2NA
D. �����£����1 L�ľ���ʳ��ˮ��һ��ʱ�������ҺpHΪ11�����������ͨ�����ߵĵ�����ĿΪ0.002NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(B)���γ�H3BO3��NaBH4��NaBO2�Ȼ������;�㷺��
(1)H3BO3ΪһԪ���ᣬ�����£���ˮ�д������µ���ƽ�⣺H3BO3 + H2O![]() [B(OH)4]-+H+��Ka=5.72��10-10��
[B(OH)4]-+H+��Ka=5.72��10-10��
��25��ʱ��0.175 mol/L��H3BO3��ҺpHԼΪ_________��
����֪̼��H2CO3�ĵ���ƽ�ⳣ��ΪKa1 = 4.4��10-7��Ka2 = 4.7��10-11��������̼������Һ�μӵ�����������Һ�У���Ӧ�����ӷ���ʽΪ_________��
(2)���ݻ��㶨Ϊ2 L���ܱ������м�������BPO4��Na���岢����һ������H2(g)�������ⷴӦ��BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) ��H��0
Na3PO4(s)+NaBH4(s) ��H��0
����ϵ��H2�����ʵ����뷴Ӧʱ��Ĺ�ϵ�����ʾ��
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
�����й�������ȷ����(����)_________��
a. �������������Ħ���������ٱ仯ʱ����Ӧ�ﵽƽ��״̬
b. 10 minʱ��������ͨ������H2�������´�ƽ��ǰ��(����)> ��(����)
c. �����¶Ȳ��䣬ƽ����ٳ���1 mol H2������ƽ��ʱH2��Ũ��Ϊ0.4 mol/L
d. �����¶ȣ��������ʼӿ죬���´ﵽƽ��ʱ����ѹǿ����
��ͼΪ�����뷴Ӧ�¶ȵĹ�ϵ���ߣ�NaBH4�IJ�����603K֮ǰ���¶����߶�������603K֮�����¶����߶���С��ԭ����_________��

(3)NaBH4(s)��H2O(l)����ˮ�⣬����������NaBO2(s)��

��ͨ��״���£�ʵ����3.8 g NaBH4(s)����ˮ�ⷴӦ�ų�21.6 kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ_________��
��![]() ΪNaBH4ˮ��İ�˥��(ˮ��һ������Ҫ��ʱ�䣬��λΪmin)��lg
ΪNaBH4ˮ��İ�˥��(ˮ��һ������Ҫ��ʱ�䣬��λΪmin)��lg![]() ��pH���¶ȵı仯��ͼ��ʾ����ҺpH=4ʱ��NaBH4_________(������������������)�ȶ����ڣ�ԭ����_________(�����ӷ���ʽ��ʾ)��T1_________T2��(�� ��>������<��)
��pH���¶ȵı仯��ͼ��ʾ����ҺpH=4ʱ��NaBH4_________(������������������)�ȶ����ڣ�ԭ����_________(�����ӷ���ʽ��ʾ)��T1_________T2��(�� ��>������<��)
�����⻯�ƾ��м�ǿ��ԭ�ԣ��������������ڴ�����Ʒ�Һ�е�CuSO4�Ƶ�����ͭ���Ӷ����Ϊ����д�����������Ӧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֹѪ��Ч�������ڶ�����ҩ�У���ṹ��ʽ��ͼ��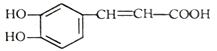 ������˵������ȷ����
������˵������ȷ����
A. ��������Է���ȡ�����ӳɡ��������������Ӿ۷�Ӧ
B. 1mol�������������4molH2��Ӧ
C. ���������������ԭ�ӿ��ܹ���
D. �佺�ķ���ʽΪC17H16O4����һ�������¿�ˮ�����ɿ������һ��һԪ��A����A�ķ���ʽΪC8H12O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ�������ԭ�ϣ�������Ϊԭ��������ϩ�ж��ַ�����
I.�����ѽ����ⷨ���÷����ķ�ӦΪ��C2H6(g)=C2H4(g)+H2(g) ��H=akJ/mol
(1)��֪101kPa��298Kʱ��C(s)��H2(g)����lmoC2H6(g)��1molC2H4(g)����H�ֱ�Ϊ��84.7 kJ/mol��+52.3kJ/mol����a=___________��
II.�����������ⷨ����ԭ�����м���������������������ķ�Ӧ���£�2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) ��H<0������Ӧ��Ϊ���ȷ�Ӧ����������CH4(g)��CO(g)��CO2(g)��ԭ����(70.1%������29.9%C2H6)�ڷ�Ӧ����ͣ��15s���������������±���
2C2H4(g)+2H2O(g) ��H<0������Ӧ��Ϊ���ȷ�Ӧ����������CH4(g)��CO(g)��CO2(g)��ԭ����(70.1%������29.9%C2H6)�ڷ�Ӧ����ͣ��15s���������������±���
��Ӧ�¶�/�� | ����ת����/% | ��ϩѡ����/% | ����/% |
750 | 80.5 | 62.9 | 50.6 |
800 | 85.6 | 64.5 | 55.2 |
850 | 92.2 | 63.2 | 58.3 |
900 | 97.6 | 59.0 | 57.6 |
(2)�ٷ�Ӧ��ƽ�ⳣ������ʽΪK=___________��K(750��)___________K(900��)(����>������<������=��)
�ڵ��¶ȳ���800��ʱ����ϩ��ѡ���Խ��ͣ�����Ҫԭ�������________________��
III.���������ⷨ����Mo-V-Nb-Sb��������Ϊ�������ڳ�ѹ��380���£���Ӧ������������ѹ[P(O2)]�������ѹ[P(C2H6)�Ĺ�ϵ����ͼ��ʾ��

(3)��֪�÷�Ӧ�����ʷ���Ϊv=kPm(O2)��Pn(C2H6)����m=___________��n=___________��
IV����Ĥȼ�ϵ�ط���
(4)������������ϩ�����CO2�Ĵ����ŷţ������о���Ա������������������ϩ������Ĥȼ�ϵ��(SOFC)����ȼ�ϵ�صĸ�����ӦʽΪ__________�����ֵ�ع���������û��CO2�ŷţ�ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ��25�桢101 kPaʱ��2 gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ���ȵ��Ȼ�ѧ����ʽΪ��2H2(g)+O2(g)![]() 2H2O(l)����H=��285.8kJ��mol-1
2H2O(l)����H=��285.8kJ��mol-1
B. CO(g)��ȼ������283.0 kJ/mol����2CO2(g)![]() 2CO(g)+O2(g)����H=+283.0 kJ/mol
2CO(g)+O2(g)����H=+283.0 kJ/mol
C. ��ϡ��Һ�У�H+(aq)+OH��(aq)= H2O(l)����H =��57.3 kJ��mol��1��������0.5 mol H2SO4��ϡ������1 mol NaOH�����ϣ��ų�����������57.3 kJ
D. ��֪C(ʯī,s) ![]() C(���ʯ,s)����H��+1.9 kJ/mol������ʯ��ʯī�ȶ�
C(���ʯ,s)����H��+1.9 kJ/mol������ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����д��Σ����������Ȼ��ƺ�����þ���ʣ��ᴿʵ�飬����ʵ����̻ش��������⣺
��1������һ����ȡ10g���Σ������ձ��к����30mLˮ�ܽ⡣Ϊ�ӿ��ܽ����ʣ��ɲ�ȡ�ķ�����________����д1�֣�
��2������������μ����Թ����ij���������ַ�Ӧ��õ���������������������˳������Ϊ���û�ѧʽ��ʾ��___________________________��
��3�������������������й��ˣ�ȡ��Һ������һ�������������ģ�����Һ�м���������________�����Լ����ƣ�������pH��7����pH��ֽ�ⶨ���������Լ���С�ļӹ����������õ��Ȼ��ƵĴ���________����С���û�С���Ӱ�졣
��4�������壺����Һ����________�н��м��ȣ��ȵ�______________________ʱ��ֹͣ���ȣ������������ɡ�
������������ת���Լ�ƿ�д��á�
��5���ڲ����������У�������������������________��________��
��6�����յõ����Ȼ��ƹ����л���������NaBr��KCl�����ij��ӷ�����________��
��7����֪��Ԫ�صĽ������ԭ������Ϊ35.5����![]() Na��
Na��![]() Cl��
Cl��![]() Cl���ɵ�11.7 gNaCl�к���
Cl���ɵ�11.7 gNaCl�к���![]() ________�ˡ�
________�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ᾧˮ����Ļ�ѧʽΪR��nH2O������Է�������ΪM��25 ��ʱ��a g�þ����ܹ�����b gˮ���γ�V mL������Һ�����й�ϵ�в���ȷ����(����)
A. ����Һ���ܶ�Ϊ����![]() g��L��1
g��L��1
B. ����Һ�����ʵ���Ũ��Ϊc��![]() mol��L��1
mol��L��1
C. ����Һ���ܼ������ʵ�������Ϊm(ˮ)��m(����)��![]() ��
��![]()
D. ����Һ�����ʵ���������Ϊw��![]() %
%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������ģ����ͼ��ʾ�������жϴ������![]() ����
����![]()

A. �����к����Լ��ͷǼ��Լ�
B. ��![]() �ӳ����ɵõ�3�ֲ���
�ӳ����ɵõ�3�ֲ���
C. �ױ�����![]() ��Һ����
��Һ����
D. ���л���ۺϷ�Ӧ�IJ���Ϊ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com