
反应4A(g)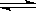 2B(g)+E(g) ΔH>0,达平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )
2B(g)+E(g) ΔH>0,达平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )
A.加压 B.减压 C.减少E的浓度 D.降温
科目:高中化学 来源: 题型:
(2)写出以NaCl、Al2O3、MgCl2、CuO、CuSO4、Ag2O为原料制备Na、Al、Mg、Cu、Ag的化学方程式,并写出它们的制备方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
| 实验装置 |
|
|
|
|
| 部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是 ( )。
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是( )
A.0.2mol/(L·min) B.0.6 mol/(L·min)
C.0.1 mol/(L·min) D.0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)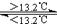 Sn(s、白) △H3=+2.1kJ/mol 下列说法正确的是 ( )
Sn(s、白) △H3=+2.1kJ/mol 下列说法正确的是 ( )
A. 灰锡转化为白锡的反应是放热反应 B. 锡在常温下以灰锡状态存在
C. △H1>△H2 D. 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)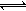 Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物 ,重新达平衡后,HCl的体积分数不变
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
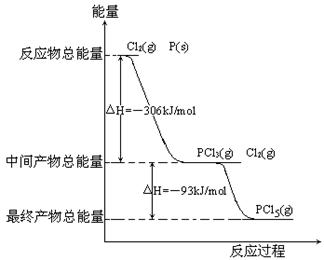 (2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α1 α2 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl3的△H1= ;P和Cl2一步反应生成
1mol PCl5的△H2 △H1(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯推测丙烯(CH2CHCH3)的结构或性质正确的是( )
A.不能使酸性高锰酸钾溶液褪色
B.不能在空气中燃烧
C.能使溴水褪色
D.与HCl在一定条件下能加成只得到一种产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com